2.4.3 Przemiany fazowe
Układ jednoskładnikowy
Dla układu jednoskładnikowego
![]() = 1
reguła faz Gibbsa (równanie 5.09) przybiera postać:
= 1
reguła faz Gibbsa (równanie 5.09) przybiera postać:
Równanie(5.301)
![]()
Stąd dla układu
jednofazowego ![]() = 1 mamy: s = 2.
= 1 mamy: s = 2.
Oznacza to, że mamy dla tego układu dwa parametry wyznaczające jego stan. Tymi parametrami są ciśnienie p oraz temperatura T. Wykres fazowy ilustrujący przemiany fazowe w układzie będzie wykresem w układzie dwóch współrzędnych: ciśnienia p oraz temperatury T. Rys. 5.04 przedstawia wykres fazowy dla wody. Na wykresie możemy wyróżnić:
1.
Obszary ciśnienia i temperatury odpowiadające trwałości jednej
fazy (![]() =
1): albo ciała stałego albo cieczy albo gazu . W
obszarach tych mamy dwa stopnie swobody (
=
1): albo ciała stałego albo cieczy albo gazu . W
obszarach tych mamy dwa stopnie swobody (
![]() ) gdyż możemy w obrębie obszaru dowolnie zmieniać ciśnienie i
temperaturę i dalej będziemy mieć do czynienia z tylko jedną fazą.
) gdyż możemy w obrębie obszaru dowolnie zmieniać ciśnienie i
temperaturę i dalej będziemy mieć do czynienia z tylko jedną fazą.
2.
Linie rozgraniczające obszary odpowiadające stanowi równowagi dwóch
faz (![]() =
2). Stan ten posiada tylko jeden stopień swobody (
=
2). Stan ten posiada tylko jeden stopień swobody (![]() ), gdyż możemy zmieniać dowolnie tylko jeden parametr (ciśnienie lub
temperaturę) aby zachować współistnienie dwóch faz. Jeśli zmieniamy
temperaturę to drugi parametr ciśnienie (prężność pary) nie jest
parametrem „swobodnym” lecz jest funkcją temperatury (równanie 5.06) i (5.08). Linie na diagramie fazowym noszą
odpowiednio nazwę krzywej sublimacji, krzywej topnienia i krzywej
parowania, a przejście przez linię z jednego obszaru do drugiego pod wpływem
zmiany ciśnienia w stałej temperaturze lub zmiany temperatury pod stałym
ciśnieniem nazywamy przemianą fazową (sublimacja-krystalizacja z fazy
gazowej, topnienie-krzepnięcie, parowanie-skraplanie).
), gdyż możemy zmieniać dowolnie tylko jeden parametr (ciśnienie lub
temperaturę) aby zachować współistnienie dwóch faz. Jeśli zmieniamy
temperaturę to drugi parametr ciśnienie (prężność pary) nie jest
parametrem „swobodnym” lecz jest funkcją temperatury (równanie 5.06) i (5.08). Linie na diagramie fazowym noszą
odpowiednio nazwę krzywej sublimacji, krzywej topnienia i krzywej
parowania, a przejście przez linię z jednego obszaru do drugiego pod wpływem
zmiany ciśnienia w stałej temperaturze lub zmiany temperatury pod stałym
ciśnieniem nazywamy przemianą fazową (sublimacja-krystalizacja z fazy
gazowej, topnienie-krzepnięcie, parowanie-skraplanie).
3.
Punkt potrójny w diagramie odpowiada współistnieniu trzech faz (![]() =
3): ciała stałego, cieczy i gazu. W punkcie tym mamy zero stopni
swobody (
=
3): ciała stałego, cieczy i gazu. W punkcie tym mamy zero stopni
swobody (
![]() ) gdyż nie możemy zmieniać parametrów wyznaczających równowagę trzech
faz. Dla wody punkt ten jest określony ciśnieniem 0,006 bara i temperaturą
0,0980C.
) gdyż nie możemy zmieniać parametrów wyznaczających równowagę trzech
faz. Dla wody punkt ten jest określony ciśnieniem 0,006 bara i temperaturą
0,0980C.
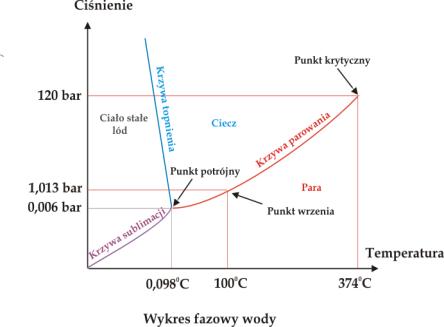
Rys.5.04.
Układ dwuskładnikowy
Dla układu dwuskładnikowego
(![]() =2) równanie Gibbsa (równanie 5.09) przybiera postać:
=2) równanie Gibbsa (równanie 5.09) przybiera postać:
Równanie(5.302)
![]()
Dla układu jednofazowego (![]() = 1) mamy największą ilość stopni swobody s = 3. Oznacza to, że układ
dwuskładnikowy określony jest trzema parametrami: ciśnieniem p,
temperaturą T i składem chemicznym (stężeniem
molowym c (VI.2.3), ułamkiem molowym lub
atomowym x (VI.2.6) etc.). Diagram fazowy będzie więc wykresem w układzie
trzech zmiennych: p, T, c.
= 1) mamy największą ilość stopni swobody s = 3. Oznacza to, że układ
dwuskładnikowy określony jest trzema parametrami: ciśnieniem p,
temperaturą T i składem chemicznym (stężeniem
molowym c (VI.2.3), ułamkiem molowym lub
atomowym x (VI.2.6) etc.). Diagram fazowy będzie więc wykresem w układzie
trzech zmiennych: p, T, c.
Duża część procesów chemicznych przebiega pod stałym ciśnieniem lub stałej temperaturze. Diagramy fazowe dla tego rodzaju procesów możemy przedstawić w formie uproszczonej. Rysunek 5.05 pokazuje diagram fazowy dla układu dwuskładnikowego w warunkach izobarycznych (p = const, 5.05a) oraz izotermicznych (T = const, 5.05b).
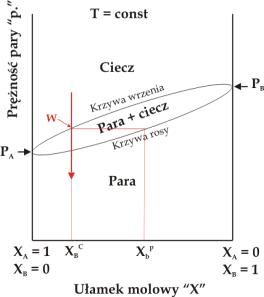 |
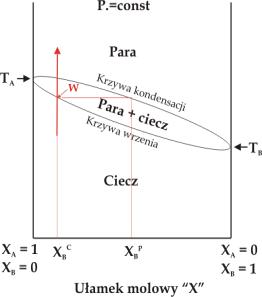
|
| (a) | (b) |
Rys.5.05. Diagram fazowy dla układu dwuskładnikowego w warunkach: (a) izotermicznych (T = const), (b) izobarycznych (p = const).
Diagramy
te ilustrują wpływ składu chemicznego układu dwuskładnikowego wyrażonego
ułamkami molowymi substancji A i B na przemiany fazowe w tym
układzie. Substancja A o wyższej temperaturze wrzenia TA jest
substancją mniej lotną niż substancja B (
![]() ). Wraz ze wzrostem ułamka molowego substancji B maleje temperatura
wrzenia układu w warunkach izobarycznych i rośnie prężność pary nad układem
w warunkach izotermicznych.
). Wraz ze wzrostem ułamka molowego substancji B maleje temperatura
wrzenia układu w warunkach izobarycznych i rośnie prężność pary nad układem
w warunkach izotermicznych.
W
diagramie fazowym możemy rozróżnić dwa obszary odpowiadające układom
jednofazowym: obszar pary i obszar cieczy. Obszary te rozdzielone są
obszarem dwufazowym: ciecz + para. Linie oddzielające obszary określają
skład cieczy (krzywa wrzenia) i pary (krzywa kondensacji lub rosy) w
momencie przemiany fazowej. Wzrost temperatury cieczy A+B o danym składzie
zaznaczony na rysunku 5.05b strzałką
do osiągnięcia temperatury wrzenia (punkt W na rys.5.05b)
powoduje pojawienie się pary której skład różni się od składu cieczy.
Para wzbogacona jest w bardziej lotny składnik B (
![]() ). Podobny efekt można uzyskać przy rozprężaniu gazu A+B w
warunkach izotermicznych (rys.5.05a).
). Podobny efekt można uzyskać przy rozprężaniu gazu A+B w
warunkach izotermicznych (rys.5.05a).
Zjawisko wzbogacenia par nad układem dwuskładnikowym w składnik bardziej lotny wykorzystuje się do rozdzielania substancji w procesach destylacji.
Znajomość przemian fazowych wyrażona poprzez diagramy fazowe ma olbrzymie znaczenie w technologii chemicznej, metalurgii i szeroko pojętej inżynierii materiałowej.