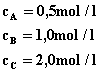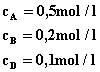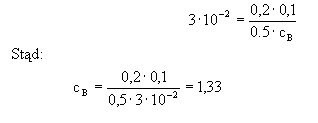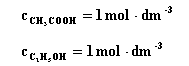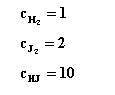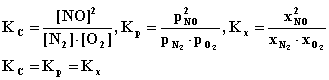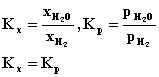3.2 Statyka, przesunięcie równowagi - zadania, przykłady
Przykłady
|
1.
Reakcja odwracalna wyraża się równaniem :
W stanie równowagi stężenia ciał biorących udział w reakcji były równe:
Obliczyć stałą równowagi i stężenia wyjściowe substancji A i B. |
|
|
Rozwiązanie: Dla podanej w temacie reakcji stała równowagi wyraża się wzorem :
Żeby obliczyć stężenia wyjściowe substancji A i B należy uwzględnić, że zgodnie z równaniem reakcji z 1 mola A i 2 moli B powstaje 1 mol C. Z tego wynika, że na utworzenie 2 moli C zostało zużyte 4 mole B i 2 mole A. W takim razie stężenia wyjściowe substancji A i B przed rozpoczęciem reakcji były równe :
Odp.: Stała równowagi reakcji wynosi 4, stężenia wyjściowe dla substancji A wynosi 2,5 mol/l a dla substancji B jest równe 5 mol/l. |
|
|
2.
Reakcja przebiega według równania : i
stała równowagi w pewnej temperaturze wynosi
|
|
|
Rozwiązanie:
Po podstawieniu danych mamy:
Odp.: Stężenie substancji B w stanie równowagi wynosi 1,33 mol/dm3. |
|
Zadania
|
1. Obliczyć stałą równowagi
reakcji estryfikacji
jeżeli stężenia początkowe są następujące :
a w stanie równowagi mieszanina reakcyjna zawiera po 2/3 mola . dm-3 estru i wody. |
|
| Odpowiedź : Wartość stałej równowagi tej reakcji to 0,25. | |
|
2.
Obliczyć skład mieszaniny gazów w stanie równowagi w reakcji : ( Reakcja przebiega w naczyniu zamkniętym). |
|
|
Odpowiedź : W stanie równowagi mamy:
|
|
|
3. Napisać wzór na stałą równowagi chemicznej Kc; Kp i Kx reakcji syntezy tlenku azotu:
Podaj zależności:
Kc - Kp i Kx - Kp × |
|
|
Odpowiedź:
|
|
| 4.
W czasie redukcji tlenku miedzi II wodorem w układzie zamkniętym ustala się
równowaga:
Napisać równanie wyrażające prawo działania mas za pomocą stałej Kx i Kp, oraz zależność między stałymi Kx i Kp . |
|
|
Odpowiedź:
|
|
| 5.
Stała równowagi reakcji w temp. 1073 K wynosi 4. Obliczyć skład
mieszaniny gazowej w stanie równowagi jeżeli zmieszano: a)
1 mol
b)
2 mole
Objętość układu wynosi 1 m3 |
|
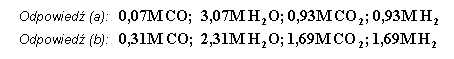 |
|
| 6. Jak wpłynie
podwyższenie ciśnienia, przy stałej temperaturze, na równowagę następujących
reakcji:
|
|
|
Odpowiedź:
|
|
| 7.
Reakcja pomiędzy stałym węglem a dwutlenkiem węgla jest reakcją
endotermiczną:
W
którą stronę przesunie się równowaga pod wpływem wzrostu temperatury? |
|
| Odpowiedź:
Równowaga przesunie się w
prawo.
|
|