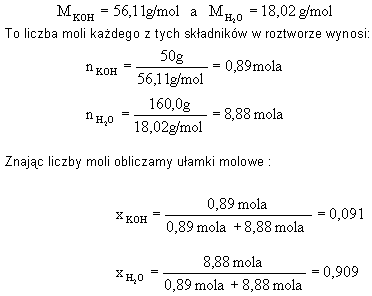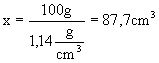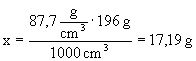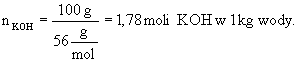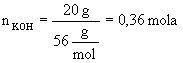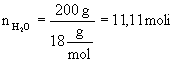2.7 Obliczanie stężeń roztworów - przykłady
|
1. Obliczyć stężenie procentowe roztworu otrzymanego ze zmieszania 30 g soli kuchennej i 170g wody. |
|||||||
|
Rozwiązanie : Masa roztworu jest sumą masy substancji rozpuszczonej i masy rozpuszczalnika : 30g + 170 g = 200g zatem jeśli w 200g roztworu znajduje się 30g soli to w 100g roztworu znajduje się x g soli |
|||||||
| 2. Ile gramów substancji znajduje się w 420g 20%-owego roztworu? | |||||||
|
Rozwiązanie: Z definicji roztworu procentowego wynika, że 20% roztwór zawiera 20g substancji w 100g roztworu. Jeśli więc w 100g roztworu jest 20g substancji
Odpowiedź: W 420g 20% roztworu znajduje się 84g substancji rozpuszczonej. |
|||||||
| 3.
Ile gramów |
|||||||
|
Rozwiązanie: Masa
molowa 0,1
mola że
jeśli w 1000cm3 0,1M roztworu znajduje się 9,8g Odpowiedź:
W 200 cm3 0,1M roztworu |
|||||||
| 4. 250 ml roztworu zawiera 3,659g chlorku sodowego. Oblicz stężenie molowe NaCl w tym roztworze. | |||||||
|
Rozwiązanie: MNaCl = 58,45 g/mol Skoro więc w 250 ml znajduje się 0,0626 moli to w 1000 ml znajduje się x moli Odpowiedź: Zgodnie z definicją molowości roztwór jest 0,25 M. |
|||||||
| 5.
50g wodorotlenku potasu rozpuszczono w 160g wody. Wyrazić w ułamkach
molowych stężenie |
|||||||
|
Rozwiązanie: Ponieważ
Odpowiedź: W podanym roztworze ułamek molowy KOH wynosi 0,091, a wody 0,909. |
|||||||
| 6.
Stężony kwas solny o gęstości 1,2g/cm3 zawiera 39,11%
wag. |
|||||||
|
Rozwiązanie: Z definicji procentowości wynika, że w 100 g kwasu znajduje się 39,11g HCl . Reszta czyli 60,89g to woda.
Odpowiedź: Ułamek molowy kwasu w podanym roztworze wynosi 0,24, a wody 0,76. |
|||||||
| 7.
Jakie jest stężenie procentowe 2 molowego roztworu kwasu siarkowego
(VI) o gęstości |
|||||||
|
Rozwiązanie : a)
obliczamy masę molową kwasu b)
ustalamy, że jeśli gęstość roztworu
c)
obliczamy ile gramów czystego
d)
obliczamy jaką objętość zajmuje 100 g roztworu o 1,14
g roztworu zajmuje objętość 100
g roztworu zajmuje objętość
----------------------------------------------------
e) aby obliczyć stężenie % - owe można : 1) korzystając z definicji stężenia procentowego określić ile gramów czystego
--------------------------------------------------------
17,19
g 2) korzystając ze wzoru :
Odpowiedź:
Stężenie procentowe roztworu |
|||||||
| 8.
W
|
|||||||
|
Rozwiązanie : 1.Obliczamy stężenie molarne : a) obliczamy ile gramów KOH zawarte jest w 1000 g wody: 200 g wody zawiera 20 g KOH
b)
obliczamy masę molową KOH c) obliczamy ilość moli KOH zawartą w 1000 g wody: 2. Obliczamy ułamki molowe poszczególnych składników roztworu : a) wiedząc, że masa molowa
b) znając liczbę moli poszczególnych składników obliczamy ułamki molowe
Odpowiedź : Stężenie molarne wynosi 1,78, a ułamki molowe składników roztworu odpowiednio 0,031 i 0,969.
|
|||||||