Słownik
A B C D E F G H I J K L Ł M N O P Q R S T U W X Y Z
Adsorpcja - koncentracja substancji na granicy faz, np. gromadzenie się substancji
zawartej w roztworze na powierzchni ciała stałego.
Aerozol - roztwór koloidalny, w którym fazę rozpraszającą stanowi powietrze
lub inny gaz.
Akumulator - ogniwo pracujące odwracalnie. Jako ogniwo galwaniczne akumulator dostarcza energii elektrycznej, natomiast pracując w trybie elektrolizera ulega „naładowaniu” wskutek odwrócenia reakcji elektrodowych pod wpływem zewnętrznego źródła prądu stałego.
Aktywność - aktywność danego składnika roztworu ai definiujemy jako iloczyn współczynnika aktywności fi (wielkości będącej miarą oddziaływań składnika z otoczeniem) oraz stężenia składnika w roztworze ci:
![]()
Aldehydy - R-CHO związki alifatyczne lub aromatyczne zawierające grupę
aldehydową –CHO np. metanal:
![]()
Alfa cząstki - jądra atomu helu ![]() emitowane podczas rozpadu
promieniotwórczego
emitowane podczas rozpadu
promieniotwórczego
Alifatyczne związki - węglowodory i ich pochodne posiadające rozgałęzione lub proste łańcuchy atomów węgla związanych wiązaniami pojedynczymi lub wielokrotnymi.
Alkany: - węglowodory alifatyczne, w których atomy węgla związane są wiązaniami
pojedynczym, o wzorze ogólnym ![]() .
.
Alkeny - węglowodory
alifatyczne, zawierające jedno wiązanie podwójne, o wzorze ogólnym![]() .
.
Alkil - grupa powstała po odłączeniu jednego atomu wodoru z alkanu o
wzorze ogólnym ![]() .
.
Alkiny - węglowodory alifatyczne, zawierające jedno wiązanie potrójne,
o wzorze ogólnym ![]() .
.
Alkohol - związek organiczny zawierający grupę hydroksylową –OH połączoną
z łańcuchem alifatycznym np.: ![]()
Alkohol polihydroksylowy:
alkohol zawierający więcej niż jedną grupę hydroksylową np.:
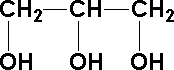
Amina - pochodna amoniaku w których atomy wodoru zostały zastąpione grupami alkilowymi lub aromatycznymi np.:
![]() ,
,

Analiza spektroskopowa - analiza jakościowa i ilościowa wykorzystująca widma spektralne substancji chemicznych.
Anizotropowe własności - niezależne od kierunku w przestrzeni.
Aromatyczne związki - pierścieniowe związki organiczne charakteryzujące się obecnością
zdelokalizowanych orbitali ![]() które nadają im specyficzne właściwości chemiczne.
które nadają im specyficzne właściwości chemiczne.
Aryl - grupa zawierająca pierścień aromatyczny
Auto-dysocjacja wody - proces samorzutnej dysocjacji wody który można opisać równaniem:
![]()
Balmera seria - linie w widmie emisyjnym wodoru obserwowane w widzialnej jego części.
Benzeno(a)piren - przedstawiciel wielopierścieniowych węglowodorów aromatycznych. W jego strukturze występuje pięć skondensowanych pierścieni benzenowych. Charakteryzuje się właściwościami rakotwórczymi i mutagennymi. Występuje jako składnik dymu tytoniowego oraz produkt niepełnego spalania paliw.
Bezwzględna skala temperatur, skala Kelwina - temperaturę w której objętość gazu doskonałego przy stałym ciśnieniu osiąga wartość zero przyjęto jako temperaturę zera bezwzględnego - początek skali Kelwina czyli bezwzględnej skali temperatur.
Stopień Kelwina (Kelwin) = 273,15 + stopień Celsjusza
Bezwzględne zero, temperatura zera bezwzględnego - temperatura w której gaz doskonały schłodzony pod stałym ciśnieniem „znika” - jego objętość V osiąga wartość zero. Temperatura ta wynosi –273,150C i jest najniższą temperaturą jaką można teoretycznie osiągnąć. W rzeczywistości w temperaturach zbliżonych do zera absolutnego (zera bezwzględnego) gaz przestaje się zachowywać jak gaz doskonały i obowiązuje równanie stanu dla gazu rzeczywistego.
Bohra teoria - teoria przedstawiająca model atomu, który umożliwił ilościową interpretację widm wodoru
Chlorowcopochodne węglowodorów - pochodne węglowodorów, w których część atomów wodoru została zastąpiona atomami fluoru, chloru, bromu lub jodu. Największe znaczenie uzyskały freony i halony. Związki te niszczą warstwę ozonową w stratosferze przyczyniając się do zwiększenia natężenia promieniowania UV na powierzchni Ziemi.
Ciało stałe - zbiór cząsteczek lub atomów oddziaływujących ze sobą tak silnie, że wszelkie ruchy translacyjne względnie rotacyjne cząsteczek (atomów) są praktycznie nie możliwe. Cząsteczki (atomy) ciała stałego mają tendencję do zajmowania ściśle określonych miejsc w przestrzeni co różni stan stały od stanu gazowego i ciekłego. Ruch cząsteczek i atomów w stanie stałym jest sprowadzony tylko do ruchów oscylacyjnych wokół ich położenia w zbiorze cząsteczek.
Ciała amorficzne ( bezpostaciowe) - ciała stałe tworzące formy przypadkowe o chaotycznym ułożeniu atomów i cząsteczek, formy których nie można opisać geometrycznie.
Ciekłe kryształy - ciała stałe które utraciły uporządkowanie trójwymiarowe charakterystyczne dla stanu krystalicznego lecz zachowały uporządkowanie dwuwymiarowe.
Ciepło parowania DHpar - ilość ciepła potrzebna do przeprowadzenia jednostkowej masy cieczy (jednego grama lub jednego mola) w parę o tej samej temperaturze.
Ciśnienie cząstkowe (parcjalne) - ciśnienie danego składnika gazu jakie ten składnik wywierałby na ścianki zbiornika gdyby zajmował całą jego objętość w danej temperaturze.
Ciśnienie osmotyczne
- ciśnienie wywołane przepływem rozpuszczalnika przez błonę półprzepuszczalną
w czasie osmozy. Przepływ ten skierowany
jest od stężenia niższego do wyższego i wywołuje ciśnienie proporcjonalne
do różnicy stężeń ![]() c
= c1-c2 po obu stronach membrany:
c
= c1-c2 po obu stronach membrany:
![]()
Defekty punktowe - nieprawidłowości w budowie sieci krystalicznej polegające na przesunięciu atomu z węzła sieci lub wbudowaniu obcego atomu w sieć krystaliczną.
Defekt masy - różnica między masą atomu a sumaryczną masą jego składników.
Definicja kwasu i zasady Brönsteda
i Lowry’ego - kwasem nazywamy substancję, która ma zdolność
odszczepienia protonu (jonu wodorowego), natomiast zasadą substancję, która
ma zdolność przyłączenia protonu. Równowaga kwasowo-zasadowa Brönsteda i
Lowry’ego zakłada, że z każdym kwasem musi być sprzężona jakaś zasada: ![]() .
.
Definicja kwasów i zasad Lewisa - kwasy są to substancje będące akceptorami pary elektronowej, natomiast zasady substancje będące donorami pary elektronowej.
Degradacja - rozkład substancji na prostsze związki chemiczne
Destylacja - metoda rozdzielenia składników tworzących roztwór oparta na zjawisku wzbogacenia pary nad wrzącym roztworem w składnik bardziej lotny.
Dioksyny - Są chlorowymi pochodnymi dibenzo-p-dioksyn lub dibenzofuranów. Bardzo trwałe połączenia chemiczne o dużej szkodliwości dla organizmów żywych. Najbardziej aktywnym biologiczne jest 2,3,7,8-tetrachlorodibenzo-p-dioksyna (TCDD).
Dipol - cząsteczka o dwóch ładunkach elektrycznych q i –q znajdujące się w odległości l.
DNA - kwas dezoksyrybonukleinowy, makrocząsteczka w kształcie podwójnej helisy: skręcone śrubowo dwa równolegle łańcuchy cukru (D-dezoksyrybozy) połączone resztami fosforanowymi, poprzecznie spojone zasadami purynowymi. Odkrywcy struktury DNA: Jamek Watson i Francis Crick zostali uhonorowani Nagrodą Nobla w 1962 r.
Dyfuzja - zjawisko ruchu cząsteczek w wyniku gradientu ich stężenia. Gradient stężenia jest „bodźcem” dyfuzji, czyli przyczyną sprawczą przepływu cząsteczek. Proces ten prowadzi do samorzutnego mieszania się cząsteczek (atomów) różnych substancji zmierzający do wyrównania gradientów (różnicy) stężeń.
Dysocjacja elektrolityczna - rozpad substancji na jony pod wpływem rozpuszczalnika.
Dziura ozonowa - zmniejszenie się stężenia ozonu w górnych partiach atmosfery wskutek reakcji z zanieczyszczeniami atmosfery (głównie tlenkami azotu i fluorochlorowęglowodorami) co powoduje w efekcie wzrost natężenia szkodliwego promieniowania UV na powierzchni Ziemi.
Efekt cieplarniany - zmiany klimatu związane ze wzrostem temperatury będące skutkiem zwiększenia
się stężenia gazów cieplarnianych w atmosferze (głównie
![]() ).
).
Efuzja - bezkolizyjny wypływ gazu ze zbiornika przez mały otwór z jednego naczynia do drugiego zmierzający do wyrównania ciśnień .
Elektroda - przewodnik elektronowy, lub półprzewodnik na powierzchni którego dochodzi do wymiany elektronów w procesie elektrochemicznym.
Elektroda wzorcowa (odniesienia) - elektroda o znanym, niezmiennym w czasie potencjale, zwanym potencjałem odniesienia.
Elektrolit - substancja ulegająca dysocjacji elektrolitycznej. Jej roztwór przewodzi prąd elektryczny, a przewodnictwo ma charakter jonowy.
Elektrolity mocne -
elektrolity, których stopień dysocjacji ![]() zbliżony
jest do jedności.
zbliżony
jest do jedności.
Elektroliza - proces zachodzący w ogniwie elektrolitycznym pod wpływem prądu dostarczanego do elektrolizera z zewnętrznego źródła prądu.
Elektron
- podstawowa cząstka występująca w
atomie o jednostkowym ładunku elementarnym ![]() i
masie
i
masie ![]()
Elektrony walencyjne - elektrony położone na zewnętrznej powłoce elektronowej atomu.
Elektroujemność - umowna miara skłonności atomu do przyciągania elektronów podczas tworzenia wiązania. L. Pauling wprowadził skala elektroujemności opierając się na energii jonizacji pierwiastków i ich powinowactwie elektronowym pierwiastków.
Energia aktywacji ![]() - bariera energetyczna, którą muszą pokonać reagujące cząstki na drodze
reakcji, wysokość bariery energii będącej różnicą pomiędzy energią
kompleksu aktywnego a energią substratów.
- bariera energetyczna, którą muszą pokonać reagujące cząstki na drodze
reakcji, wysokość bariery energii będącej różnicą pomiędzy energią
kompleksu aktywnego a energią substratów.
Energia jonizacji - energia jaką trzeba dostarczyć do atomu, aby usunąć elektron z atomu i utworzyć jon dodatni.
Energia wiązania - defekt masy (przeliczony zgodnie z równaniem Einsteina) odniesiony do 1 nukleonu nosi nazwę energii wiązania
Entalpia
- termodynamiczna funkcja
stanu definiowana równaniem H = U + pV. Nie
jest możliwe wyznaczenie bezwzględnej wartości entalpii układu. Drogą
pomiarów można określić jej zmianę (![]() H),
której wartość równa jest ciepłu procesu (np. reakcji chemicznej)
prowadzonego w warunkach izobarycznych.
H),
której wartość równa jest ciepłu procesu (np. reakcji chemicznej)
prowadzonego w warunkach izobarycznych.
Entalpia standardowa - oznaczana symbolem ![]() określa zmianę entalpii w warunkach standardowych (p =
101325 Pa, T = 298,16 K)
określa zmianę entalpii w warunkach standardowych (p =
101325 Pa, T = 298,16 K)
Entalpia swobodna - termodynamiczna funkcja stanu definiowana równaniem ![]() .
Entalpia swobodna określa maksymalną ilość pracy użytecznej jaką może
wykonać układ w danych warunkach.
.
Entalpia swobodna określa maksymalną ilość pracy użytecznej jaką może
wykonać układ w danych warunkach.
Entalpia swobodna reakcji, standardowa - zmiana entalpii swobodnej podczas przebiegu reakcji chemicznej w
warunkach standardowych ![]() .
Procesy przebiegające samorzutnie charakteryzują się ujemną wartością
entalpii swobodnej. W warunkach równowagi termodynamicznej zmiana
.
Procesy przebiegające samorzutnie charakteryzują się ujemną wartością
entalpii swobodnej. W warunkach równowagi termodynamicznej zmiana ![]() jest
równa zeru.
jest
równa zeru.
Entropia - ilościowa miara stopnia nieuporządkowania układu. Im więcej możliwych stanów realizacji układu, tym większa jego entropia zgodnie z równaniem Boltzmana S = k lnW, w którym k = – stała Boltzmana 1.38 x 10-23 J/K, a W jest liczbą możliwych (prawdopodobnych) stanów realizacji układu. W termodynamice chemicznej entropia to funkcja stanu definiowana równaniem:
![]()
Estry - pochodne kwasów karboksylowych lub tlenowych kwasów nieorganicznych z alkoholami lub fenolami.
Faza - jednorodna część układu odgraniczona od pozostałych części układu wyraźnymi granicami międzyfazowymi.
Fenole - związki posiadające grupę hydroksylową (jedną lub kilka) związaną z węglem zawartym w pierścieniu aromatycznym o wzorze ogólnym Ar-OH.
Fotochemia - dziedzina chemii badająca wpływ promieniowania elktromagnetycznego na przebieg reakcji chemicznych.
Fotodekompozycja - fotochemiczna reakcja rozkładu
Fotodysocjacja - rozpad cząsteczki na atomy pod wpływem promieniowania elektromagnetycznego
Freony - chlorowcopochodne metanu lub etanu (np.: ![]() ,
,![]() )
będące łatwo lotnymi cieczami. Zmianie stanu skupienia towarzyszy znaczny
efekt cieplny, co spowodowało, że związki te znalazły zastosowanie w chłodnictwie.
Niektóre z nich ponadto zostały wykorzystane jako środek nośny substancji
czynnej (kosmetyku, lakieru, farmaceutyku itp.) w aerozolowych zbiornikach ciśnieniowych.
)
będące łatwo lotnymi cieczami. Zmianie stanu skupienia towarzyszy znaczny
efekt cieplny, co spowodowało, że związki te znalazły zastosowanie w chłodnictwie.
Niektóre z nich ponadto zostały wykorzystane jako środek nośny substancji
czynnej (kosmetyku, lakieru, farmaceutyku itp.) w aerozolowych zbiornikach ciśnieniowych.
Gaz doskonały - model gazu oparty na założeniu że: (a) gaz składa się z cząsteczek (atomów) będących w nieustającym, przypadkowym ruchu, (b) cząsteczki (atomy) można traktować jako punkty bezwymiarowe (można zaniedbać wymiary cząsteczek), (c) średnica cząsteczek (atomów) jest znacznie mniejsza od średniej drogi między zderzeniami, (d) zderzenia cząsteczek i atomów są „zderzeniami sprężystymi”.
Gaz elektronowy
Fermiego - w metalach elektrony walencyjne są „zdelokalizowane” i
tworzą „chmurę elektronową” (gaz elektronowy Fermiego) przenikającą cały
kryształ. Obecność „gazu elektronowego” ogranicza siły odpychania pomiędzy
kationami tworzącymi sieć i stabilizuje w ten sposób strukturę krystaliczną
metalu. W ![]() metalu
znajduje się około
metalu
znajduje się około ![]() swobodnych
elektronów.
swobodnych
elektronów.
Gaz rzeczywisty - model gazu w którym uwzględniono oddziaływania międzycząsteczkowe oraz objętość własną cząsteczek lub atomów.
Halon – chlorowcowęglowodory zawierające
atomy fluoru, chloru lub bromu, które ze względu na niepalność i dużą gęstość,
znalazły zastosowanie jako środki gaśnicze. Np.: ![]() ,
,
![]()
Gramorównoważnik - wal – ilość substancji w gramach równa jego równoważnikowi chemicznemu tzn. takiej jej ilości wyrażonej w częściach wagowych, która łączy się lub zastępuje 8 części wagowych tlenu lub 1 część wagową wodoru.
Hybrydyzacja - zmiany następujące w strukturze elektronowej atomu, w trakcie tworzenia wiązań chemicznych, polegające na ujednorodnieniu orbitali atomowych. Powstają nowe orbitale o korzystniejszym usytuowaniu przestrzennym umożliwiające powstanie trwalszych wiązań chemicznych. W hybrydyzacji mogą brać udział orbitale s, p i d. Np. w wyniku hybrydyzacji orbitalu s z trzema orbitalami p atom węgla może utworzyć cztery jednakowe wiązania tworzące strukturę tetraedryczną. Kształt i rozmiar orbitali jest identyczny, a kąty między nimi są równe i wynoszą 109,5°.
Hydrofilowość (cząsteczki lub jej części) - właściwości polarnej lub naładowanej cząsteczki oddziaływującej z wodą z utworzeniem wiązań wodorowych. Zawierają zwykle w strukturze grupy hydroksylowe, karboksylowe, aminowe lub inne zdolne do utworzenia wiązań wodorowych.
Hydrofobowość (cząsteczki lub jej części) - właściwości cząstek niepolarnych o niewielkim powinowactwie do wody. Zawierają w swej strukturze grupy niepolarne np. łańcuchy węglowodorowe
Hydroksyl
- 1. grupa –OH w cząsteczce związku organicznego. 2. rodnik ![]() zawierający
niesparowany elektron
zawierający
niesparowany elektron
Hydroliza - reakcja z wodą (np. estrów lub niektórych soli), w wyniku której powstają dwa lub więcej produkty
Hydroliza soli - reakcja jonów z cząsteczkami wody w wyniku której następuje rozkład cząsteczki wody z uwolnieniem jonu wodorowego lub hydroksylowego. Następuje zatem zakwaszenie lub alkalizacja roztworu wodnego.
Iloczyn jonowy wody
- iloczyn stężeń jonów wodorowych i jonów
hydroksylowych. W temperaturze pokojowej (200C ) i pod ciśnieniem
atmosferycznym (1,013bara) iloczyn ten wynosi: ![]() .
.
Iloczyn rozpuszczalności - iloczyn stężeń jonowych danej substancji jonowej w roztworze nasyconym:
![]()
gdzie ![]() oznacza
stężenie molowe, natomiast
oznacza
stężenie molowe, natomiast ![]() współczynnik
stechiometryczny substancji i.
współczynnik
stechiometryczny substancji i.
Ilość składników niezależnych - minimalna ilość składników potrzebna do zbudowania układu. Ilość składników niezależnych danego układu jest równa ilości składników obecnych w układzie pomniejszonej o ilość równań chemicznych wiążących te składniki.
Izobara - zależność funkcyjna pomiędzy dwiema wielkościami przy zachowaniu stałego ciśnienia układu.
Izobaryczna przemiana - przemiana fizyczna lub chemiczna przebiegająca pod stałym ciśnieniem.
Izochora - zależność funkcyjna pomiędzy dwiema wielkościami przy zachowaniu stałej objętości układu.
Izochoryczna przemiana - przemiana fizyczna lub chemiczna przebiegająca w stałej objętości układu.
Izolator - substancja dla której przeniesienie elektronu z pasma podstawowego (walencyjnego) do pasma przewodnictwa wymaga energii 5-10eV.
Izomery – związki chemiczne o tym samym wzorze sumarycznym różniące się budową
Izoterma - zależność funkcyjna pomiędzy dwiema wielkościami w stałej temperaturze.
Izotermiczna przemiana - przemiana fizyczna lub chemiczna przebiegająca w stałej temperaturze (przy zachowaniu stałej temperatury układu).
Izotopy - atomy pierwiastków o tej samej liczbie atomowej różniące się ilością neutronów w jądrze
Izotropowe własności - własności zależne od kierunku w przestrzeni.
Izotropia - jednorodność właściwości fizycznych niezależnie od kierunku. Przeciwstawna cecha nosi nazwę anizotropii.
Jon hydroniowy
![]() - kation wodorowy (zjonizowany atom wodoru –
proton) solwatowany jedną cząsteczką wody:
- kation wodorowy (zjonizowany atom wodoru –
proton) solwatowany jedną cząsteczką wody: ![]() .
.
Kataliza - zjawisko przyspieszania szybkości reakcji chemicznej przez substancje nie biorące udziału w tej reakcji (katalizatory).
Kataliza homogeniczna (jednofazowa) - proces katalizy w którym katalizator stanowi jeden ze składników jednorodnej fazy (gazowej lub ciekłej) w której zachodzi reakcja.
Kataliza heterogeniczna (wielofazowa) - proces katalizy w którym katalizator stanowi odrębną fazę w układzie reagującym, a katalizowana reakcja przebiega na granicy faz.
Katalizator - substancja która wprowadzona do układu reagującego zwiększa szybkość tej reakcji a sama nie ulega przemianom chemicznym w ostatecznym wyniku reakcji.
Katenacja - właściwość niektórych pierwiastków, przede wszystkim węgla, do tworzenia połączeń zawierających długie łańcuchy atomów tego pierwiastka.
Keton - związek organiczny zawierający grupę karbonylową ![]() o
wzorze ogólnym
o
wzorze ogólnym ![]()
Kinetyka chemiczna - dział chemii zajmujący się badaniami szybkości reakcji chemicznych.
Koloid - roztwór niewłaściwy, układ mikroheterogeniczny, zawierający fazę rozpraszającą i faze rozproszoną, której wielkość cząstek jest zawarta w przedziale 1 – 200 nm.
Komórka elementarna - najprostszy element budowy kryształu przez którego powtórzenie w przestrzeni (translację) można odtworzyć strukturę ciała stałego.
Kryształy - ciała stałe w których cząsteczki, atomy zajmują ściśle określone położenie w przestrzeni tworząc geometryczne formy przestrzenne – układy krystalograficzne.
Kryształy jonowe - kryształy zbudowane przy pomocy wiązań jonowych. W węzłach sieci krystalicznej znajdują się kationy i aniony tworzące podsieci: kationową i anionową.
Kryształy kowalentne - kryształy zbudowane z pomocą wiązań atomowych. W węzłach sieci krystalicznej znajdują się cząsteczki lub atomy.
Kryształy molekularne - kryształy zbudowane z cząsteczek okupujących węzły sieci krystalicznej.
Kryształy o wiązaniu metalicznym – metale - w sieci metalicznej węzły sieci przestrzennej są obsadzone przez atomy pozbawione elektronów walencyjnych (tzw. "zręby atomowe” – jony dodatnie). Elektrony walencyjne są „zdelokalizowane” i tworzą „chmurę elektronową” (gaz elektronowy Fermiego) przenikającą cały kryształ. Obecność „gazu elektronowego” ogranicza siły odpychania pomiędzy kationami tworzącymi sieć i stabilizuje w ten sposób strukturę krystaliczną metalu.
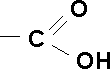
Kwas karboksylowy - związek organiczny posiadający grupę karboksylową
Lepkość cieczy - ograniczenie
wzajemnego ruchu cząsteczek cieczy w wyniku silnych oddziaływań międzycząsteczkowych.
Lepkość dynamiczną ![]() definiujemy jako:
definiujemy jako:
![]()
gdzie: F jest siłą potrzebną do wywołania różnicy szybkości dv dwóch warstw cieczy wzdłuż odcinka dx i powierzchni styku S.
Liczba atomowa - liczba protonów w jądrze pierwiastka.
Liczba Avogadra N - liczba atomów, jonów lub cząsteczek w
jednym molu substancji równa ![]()
Liczby kwantowe - główna liczba kwantowa n, poboczne liczba kwantowa l, magnetyczna liczba kwantowa m - charakteryzujące stan energetyczny atomu.
Liczba masowa - sumaryczna ilość protonów i neutronów w jądrze atomu.
Ligandy - cząsteczki lub jony tworzące z atomem centralnym związek kompleksowy
Lotne związki organiczne - substancje gazowe lub ciekłe o niskiej temperaturze wrzenia. Należą do nich m.in. węglowodory, organiczne rozpuszczalniki (aceton, chlorek metylenu, trichloroetylen, czterochlorek węgla, benzen), benzyna.
Masa atomowa - podaje masę danego atomu w jednostkach mas atomowych (j.m.a.) oznaczanych skrótem u (od angielskiego słowa unit). Jednostka masy atomowej u równa jest 1,660*10-24 g.
Masa molowa
M - masą jednego mola czyli masa ![]() atomów
lub cząsteczek danej substancji.
atomów
lub cząsteczek danej substancji.
Maxwella-Boltzmanna równanie - równanie przedstawiające statystyczny rozkład szybkościi cząsteczek gazu w danej temperaturze T:
Moment dipolowy - iloczyn
ładunku q i odległości l: ![]() ,
ma wymiar kulomb*metr (C·m). Zwykle wyraża się go w jednostce zwanej debajem:
,
ma wymiar kulomb*metr (C·m). Zwykle wyraża się go w jednostce zwanej debajem:
![]()
Napięcie powierzchniowe
- zjawisko powstające na granicy faz ciecz – gaz.
Silniejsze oddziaływania międzycząsteczkowe w cieczy powoduje powstanie siły
wypadkowej dążącej do ograniczenia powierzchni cieczy. Napięcie
powierzchniowe ![]() definiujemy
jako stosunek pracy W potrzebnej do zmiany swobodnej powierzchni cieczy
do zmiany tej powierzchni S:
definiujemy
jako stosunek pracy W potrzebnej do zmiany swobodnej powierzchni cieczy
do zmiany tej powierzchni S:
![]()
Neutron - elementarna cząstka ta wchodząca w skład jądra atomowego wszystkich pierwiastków (z wyłączeniem wodoru). Charakteryzuje się masą podobną do masy protonu 1,6749*10-24 g oraz brakiem ładunku elektrycznego. Neutron jest stabilną cząstką, jeśli występuje w jądrze atomu. Występując poza jądrem swobodny neutron jest nietrwały i ulega rozpadowi z powstaniem protonu. Czas połowicznego rozpadu wynosi ok. 17 minut.
Objętość molowa
- objętość jednego mola gazu doskonałego w
warunkach normalnych: ![]() :
:![]()
Oddziaływanie elektrostatyczne - oddziaływanie zachodzące między ładunkami elektrostatycznymi
Ogniwo Daniella - ogniwo
elektrochemiczne ![]() .
.
Ogniwo elektrochemiczne - układ dwóch elektrod spiętych przewodnikiem metalicznym, zanurzonych w elektrolicie. Elektroda na której zachodzi reakcja utleniania nosi nazwę anody, natomiast elektrodę na której zachodzi reakcja redukcji nazywamy katodą.
Ogniwo elektrolityczne - ogniwo w którym reakcje elektrodowe są wynikiem przepływu prądu wymuszonego przez zewnętrzne źródło napięcia, większego niż SEM ogniwa.
Ogniwo galwaniczne - ogniwo, w którym procesy elektrodowe przebiegają spontanicznie, a wskutek ich przebiegu następuje przepływ prądu w zewnętrznym przewodniku elektronowym.
Ogniwo Leclanche’go
- ogniwo zbudowane z katody grafitowej i cynkowej
anody ![]() .
Elektrolitem jest nasycony roztwór chlorku amonu. Katoda grafitowa pokryta jest
warstwą dwutlenku manganu w celu ograniczenia polaryzacji tej elektrody w
czasie pracy ogniwa. SEM ogniwa Leclanche’go wynosi 1.5V .
.
Elektrolitem jest nasycony roztwór chlorku amonu. Katoda grafitowa pokryta jest
warstwą dwutlenku manganu w celu ograniczenia polaryzacji tej elektrody w
czasie pracy ogniwa. SEM ogniwa Leclanche’go wynosi 1.5V .
Okres połowicznego rozpadu - czas po którym przemianie ulega połowa ilości substratu.
Opór właściwy - odwrotność
przewodnictwa właściwego ![]() :
:
![]()
Orbital atomowy - funkcje własne będące rozwiązaniem równania Schrödingera, które można scharakteryzować za pomocą trzech liczb kwantowych głównej liczby kwantowej n, pobocznej liczby kwantowej l, magnetycznej liczby kwantowej m.
Orbital antywiążący - orbital molekularny powstały w wyniku nałożenia się orbitali atomowych charakteryzujący się wyższą energią od wyjściowych orbitali atomowych
Osmoza - przepływ rozpuszczalnika przez błonę półprzepuszczalną (błonę przepuszczającą tylko cząstki rozpuszczalnika) dążący do wyrównania stężeń po obu stronach membrany.
Parametry stanu
- parametry fizyczne i chemiczne wyznaczające stan układu. Należą do
nich stężenie, liczba faz, ciśnienie, objętość i temperatura. W układach
jednofazowych liczba parametrów stanu ogranicza się do stężenia (liczby
moli), ciśnienia, objętości i temperatury.
Pasmo przewodnictwa - rozmycie się
ściśle zdefiniowanych poziomów energetycznych elektronów atomów (jonów) położonych
wewnątrz sieci krystalicznej wskutek oddziaływania sąsiednich jonów.
Pestycydy - nazwa chemicznych środków ochrony roślin przed szkodnikami (chwastami, grzybami, owadami, gryzoniami). Najbardziej znanym, powszechnie stosowanym, a obecnie wycofanym z użycia ze względu na szkodliwe właściwości, jest DDT (p,p'-dichlorodifenylotrichloroetan).
pH-metr - przyrząd
do elektrochemicznego pomiaru pH. Pomiar oparty jest na liniowej zależności
potencjału elektrody wodorowej od pH zgodnie z równaniem Nernsta: ![]() .
.
pH roztworu – definicja
-
![]()
Wartość pH jest powszechnie przyjętą miarą kwasowości roztworów. W rozcieńczonych roztworach wodnych (roztworach doskonałych) może ona przyjmować wartości od 0 do 14.
Pierwiastek – zbiór atomów o charakteryzujących się jednakową liczbą atomową.
Polaryzowalność cząsteczki
- zdolność cząsteczki do tworzenia momentu
dipolowego w wyniku działania zewnętrznego pola elektrycznego (także pola
wytworzonego przez pobliski jon lub naładowaną cząsteczkę). Wartość
indukowanego momentu ![]() jest
proporcjonalna do natężenia działającego pola E:
jest
proporcjonalna do natężenia działającego pola E: ![]() .
Stała
.
Stała ![]() nosi
nazwę polaryzowalności.
nosi
nazwę polaryzowalności.
Potencjał elektrodowy. Równanie Nernsta - zależność potencjału elektrochemicznego E od aktywności substancji potencjałotwórczych (uczestniczących w reakcji elektrodowej) można opisać równaniem Nernsta:
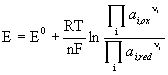
gdzie ![]() oznacza
iloczyn stężeń aktywności substancji utlenionych, natomiast
oznacza
iloczyn stężeń aktywności substancji utlenionych, natomiast
![]() iloczyn
aktywności substancji zredukowanych.
iloczyn
aktywności substancji zredukowanych. ![]() jest
potencjałem standardowym reakcji.
jest
potencjałem standardowym reakcji.
Potencjał standardowy
- potencjałem standardowym ![]() nazywamy
potencjał równowagowy danego procesu elektrochemicznego jeśli stosunek
aktywności substancji utlenionej i substancji zredukowanej jest równy jedności.
Potencjał standardowy można obliczyć z danych termodynamicznych -
standardowych potencjałów chemicznych
nazywamy
potencjał równowagowy danego procesu elektrochemicznego jeśli stosunek
aktywności substancji utlenionej i substancji zredukowanej jest równy jedności.
Potencjał standardowy można obliczyć z danych termodynamicznych -
standardowych potencjałów chemicznych ![]() substancji
biorących udział w reakcji elektrochemicznej posługując się równaniem:
substancji
biorących udział w reakcji elektrochemicznej posługując się równaniem:
![]()
Polimer - substancja o dużej masie cząsteczkowej składająca się z wielokrotnie powtarzających się jednostek zwanych merami.
Prężność pary - ustalone w danej temperaturze ciśnienie gazu nad cieczą.
Prawo Avogadra - jednakowe objętości różnych gazów znajdujących się pod tym samym ciśnieniem i w tej samej temperaturze zawierają jednakową liczbę cząsteczek.
Prawo Boyle’a – Mariotte’a - prawo opisujące przemianę izotermiczną:
![]()
![]()
Iloczyn ciśnienia i objętości gazu jest wielkością stałą w stałej temperaturze.
Prawo Charlesa - prawo opisuje przemianę izochoryczną:
ani![]()
![]() oznacza
ciśnienie danej masy gazu w temperaturze 00C, a
oznacza
ciśnienie danej masy gazu w temperaturze 00C, a ![]() jest
współczynnikiem rozszerzalności równym
jest
współczynnikiem rozszerzalności równym ![]() .Po
wprowadzeniu do równań temperatury bezwzględnej otrzymamy zależność:
.Po
wprowadzeniu do równań temperatury bezwzględnej otrzymamy zależność:
Równani![]()
W stałej objętości ciśnienie danej masy gazu jest wprost proporcjonalne do temperatury.
Prawo Daltona - całkowite ciśnienie mieszaniny gazów jest równe sumie ciśnień cząstkowych poszczególnych składników:
![]()
gdzie
![]() .
.
Prawo dyfuzji Grahama - szybkość dyfuzji i efuzji gazów w stałej temperaturze i przy stałej różnicy ciśnień zależy od szybkości ruchu cząsteczek, a więc od gęstości gazów oraz ich masy molowej:
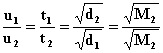
gdzie:
u - szybkość dyfuzji,
t - czas wypływu gazu (w przypadku efuzji),
d - gęstość gazu,
M – masa cząsteczkowa gazu.
Prawo działania mas – prawo równowagi chemicznej (Guldberga i Waagego) - w stanie równowagi chemicznej stosunek iloczynu stężeń produktów reakcji (w potęgach ich współczynników stechiometrycznych) do iloczynu stężeń substratów (w potęgach ich współczynników stechiometrycznych) jest w danych warunkach ciśnienia i temperatury wielkością stałą i charakterystyczną dla danej reakcji.
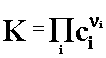
gdzie:
![]() - współczynniki stechiometryczne, dodatnie dla produktów, ujemne dla substratów.
Stała K nosi nazwę stałej równowagi chemicznej.
- współczynniki stechiometryczne, dodatnie dla produktów, ujemne dla substratów.
Stała K nosi nazwę stałej równowagi chemicznej.
Prawo Faradaya - natężenie prądu elektrolizy jest proporcjonalne do szybkości reakcji elektrochemicznej zachodzącej w trakcie tego procesu:
![]()
gdzie n oznacza liczbę elektronów wymienianych w procesie elektrochemicznym, a νi oznacza ilość moli substancji „i” biorącej udział w tym procesie. F jest wielkością stałą zwaną stałą Faradaya.
Prawo Gay-Lussaca - prawo opisujące przemianę izobaryczną:
Przy stałym ciśnieniu objętość danej masy gazu jest wprost proporcjonalna do temperatury:
![]()
![]() jest
objętością danej masy gazu w temperaturze
jest
objętością danej masy gazu w temperaturze ![]() .Współczynnik
rozszerzalności a jest jednakowy dla wszystkich gazów i wynosi
.Współczynnik
rozszerzalności a jest jednakowy dla wszystkich gazów i wynosi ![]() stąd:
stąd:
![]()
Przy stałym ciśnieniu objętość danej masy gazu jest wprost proporcjonalna do temperatury.
Prawo Henry’ego - stężenie gazu rozpuszczonego (cA) w cieczy jest proporcjonalne do ciśnienia cząstkowego (parcjalnego) tego gazu nad cieczą:
![]() ,
, ![]()
Prawo przesunięć Soddy’ego – Fajansa
- określa
przemiany promieniotwórcze. Gdy przemianie promieniotwórczej towarzyszy emisja
promieniowania ![]() ,
to następuje przemiana atomów jednego pierwiastka w drugi, przy czym liczba
masowa nowego pierwiastka jest mniejsza o 4 jednostki, a liczba atomowa o dwie.
Przy przemianie z emisją promieniowania
,
to następuje przemiana atomów jednego pierwiastka w drugi, przy czym liczba
masowa nowego pierwiastka jest mniejsza o 4 jednostki, a liczba atomowa o dwie.
Przy przemianie z emisją promieniowania ![]() liczba
masowa nowego pierwiastka pozostaje bez zmian, a liczba atomowa zwiększa się o
1.
liczba
masowa nowego pierwiastka pozostaje bez zmian, a liczba atomowa zwiększa się o
1.
Prawo
Raulta - prężności pary „pi”
składnika „i” nad roztworem jest proporcjonalna do prężności pary „![]() ”tego
składnika nad czystą substancją „i” oraz ułamka molowego „
”tego
składnika nad czystą substancją „i” oraz ułamka molowego „![]() ”
tego składnika w roztworze:
”
tego składnika w roztworze:
![]()
Prawo rozcieńczeń Ostwalda - zależność pomiędzy stopniem dysocjacji a stałą dysocjacji:
(
![]()
gdzie c oznacza stężenie molowe molowe elektrolitu.
Dla elektrolitów słabych, gdy ![]() równanie
można przedstawić w formie uproszczonej:
równanie
można przedstawić w formie uproszczonej:
![]()
Promieniowanie ![]() - strumień jąder helu
- strumień jąder helu ![]()
Promieniowanie ![]() - strumień elektronów
- strumień elektronów
Promieniowanie ![]() - promieniowanie
elektromagnetyczne
- promieniowanie
elektromagnetyczne
Proton - podstawowa cząstka elementarna o masie 1,6726*10-27 kg i jednostkowym dodatnim ładunku +1,602*10-19 C
Przemiana fazowa - przemiana fizykochemiczna w wyniku której następuje przekształcenie jednej fazy w drugą. Przykładem mogą być zmiany stanu skupienia (parowanie, topnienie, sublimacja).
Przepływ laminarny - przepływ płynu warstwowy, w którym tory cząsteczek są równoległe i warstwy nie ulegają mieszaniu się
Przestrzeń międzywęzłowa - przestrzeń między węzłami tzn. między punktami, obsadzonymi przez atomy, cząsteczki lub jony, powtarzającymi się regularnie w sieci kryształu
Przewodnictwo jonowe - przewodnictwo spowodowane ruchem jonów (kationów i / lub anionów) w polu elektrycznym.
Przewodnictwo równoważnikowe
![]() - jest to przewodnictwo właściwe odniesione do
przewodnictwa centymetrowej warstewki roztworu zawierającej jeden gramorównoważnik
substancji:
- jest to przewodnictwo właściwe odniesione do
przewodnictwa centymetrowej warstewki roztworu zawierającej jeden gramorównoważnik
substancji:
![]()
gdzie c oznacza stężenie normalne roztworu.
Przewodnictwo elektronowe - przewodnictwo związane z ruchem elektronów „zdelokalizowynch” (elektronów znajdujących się w paśmie przewodnictwa) w polu elektrycznym.
Przewodnictwo właściwe
- przewodnictwo właściwe
![]() definiujemy
jako:
definiujemy
jako:
![]()
gdzie R [ohm] jest oporem
warstewki elektrolitu o przekroju
![]() i
długości l [cm].
i
długości l [cm].
Półogniwo - przestrzeń składająca się z elektrody i elektrolitu oddzielona od pozostałej elektrody diafragmą .
Półprzewodnik - substancja
dla której pasmo podstawowe (walencyjne) jest odizolowane od pasma
przewodnictwa pasmem wzbronionym o szerokości (różnicy energii) 0,1 do 4 eV.
Przeniesienie elektronu z pasma podstawowego do pasma przewodnictwa powoduje
powstanie w nim luki elektronowej („dziury”). Tak nie obsadzony poziom zwany
„dziurą” może przemieszczać się w paśmie walencyjnym podobnie jak
elektron w paśmie przewodnictwa w wyniku działania pola elektrycznego.
Przemieszczanie się dziur można traktować jako przemieszczanie się
dodatniego ładunku elementarnego (luka elektronowa jest równoważna nadmiarowi
elementarnego ładunku dodatniego). Rozróżniamy zatem przewodnictwo dziurowe
(wywołane transportem luk elektronowych) i elektronowe (wywołane transportem
elektronów). Wynosi one dla półprzewodników od ![]() .
.
Pył zawieszony - układ koloidalny składający się z fazy rozproszonej (ciało stałe) i fazy rozpraszającej którą jest powietrze
Reakcja anodowa, anoda - reakcja utleniania substancji w wyniku oddawania elektronów do pasma przewodnictwa przewodnika elektronowego -elektrody. Elektrodę na której zachodzi reakcja utleniania nazywamy anodą.
Reakcje elektrochemiczne - reakcje utleniania i redukcji zachodzące z udziałem elektronów wymienianych z przewodnikiem elektronowym - elektrodą .
Reakcje homogeniczne - reakcje przebiegające w układzie jednofazowym.
Reakcje heterogeniczne -reakcje przebiegające w układzie wielofazowym.
Reakcja katodowa, katoda - reakcja redukcji substancji w wyniku pobierania elektronów z przewodnika elektronowego - elektrody. Elektroda na której zachodzi reakcja katodowa nosi nazwę katody.
Reakcje utleniania-redukcji (reakcje redoks) - reakcje w których dochodzi do wymiany elektronów pomiędzy substancjami reagującymi.
Redukcja - reakcja w wyniku której substancja przyłącza elektrony.
Reguła faz Gibbsa - każdy układ chemiczny określony jest przez liczbę faz b oraz liczbę składników a niezbędnych do zbudowania tego układu. Ilość faz oraz składników jaka może występować w danym układzie jest zależna od temperatury, ciśnienia. Zależność tę ujmuje reguła faz Gibbsa:
![]()
gdzie: s ilość stopni swobody, czyli parametrów które możemy dowolnie zmieniać bez zmiany ilości składników a i ilości faz b w danym układzie,
Reguła przekory Le Chateliera i Browna - jeżeli układ będący w stanie równowagi poddamy działaniu zewnętrznemu, tj. zmianie stężenia reagentów, zmianie ciśnienia lub zmianie temperatury, to równowaga chemiczna w tym układzie przesunie się w kierunku kompensacji tych zmian.
Rozkład statystyczny
Maxwella-Boltzmanna - Ilość cząsteczek
o energii równej lub większej niż energia aktywacji ![]() dana
jest rozkładem statystycznym:
dana
jest rozkładem statystycznym:
![]()
gdzie:
![]() jest
ilością cząsteczek o energii większej niż energia aktywacji
jest
ilością cząsteczek o energii większej niż energia aktywacji
![]() ,
,
![]() całkowitą
ilością cząsteczek,
całkowitą
ilością cząsteczek,
k stałą Boltzmanna,
T temperaturą w skali bezwzględnej (Kelwina).
Rozpuszczalność -
maksymalna ilość substancji jaką można rozpuścić
w jednostce objętości rozpuszczalnika w określonej temperaturze i ciśnieniu.
Rozpuszczalność wyrażana jest przeważnie w gramach substancji rozpuszczonej
w
![]() rozpuszczalnika
rozpuszczalnika
![]() .
.
Rozpuszczanie - tworzenie roztworu w wyniku oddziaływania substancji rozpuszczanej z rozpuszczalnikiem.
Roztwór - roztworem nazywamy wieloskładnikowy układ jednofazowy (homogeniczny). Składnik znajdujący się w ilościowej przewadze nosi nazwę rozpuszczalnika, podczas gdy pozostałe składniki tworzące roztwór noszą nazwę substancji rozpuszczonej. Pod względem fizycznym roztwór jako układ jednofazowy musi się charakteryzować molekularnym rozproszeniem wszystkich jego składników.
Roztwór doskonały - roztwór w którym nie ma „silnych” oddziaływań pomiędzy składnikami (cząsteczkami rozpuszczalnika A i substancji rozpuszczonej B) i poszczególne składniki zachowują się w układzie wieloskładnikowym (roztworze) tak samo jak w stanie jednoskładnikowym ( w czystej substancji). Ma to miejsce gdy energia oddziaływań międzymolekularnych jest taka sama w przypadku oddziaływania A-A, B-B i A-B.
Roztwór koloidalny - drobno dyspergowany układ wielofazowy (o wielkości cząsteczek rozproszonych w przedziale 1-200 nm). W sensie fizycznym „roztwór koloidalny” nie jest roztworem lecz mieszaniną.
Roztwór obojętny
- roztwór w którym stężenie jonów wodorowych jest równoważne
stężeniu jonów hydroksylowych. W obojętnym roztworze wodnym mamy:
![]() .
.
Roztwór nasycony - roztwór pozostający w równowadze z substancją nie rozpuszczoną.
Roztwór rzeczywisty - roztwór o molekularnym rozproszeniu składników (< 1 nm).
Roztwory buforowe - roztwory zachowujące stałą wartość pH i nieczułe na niewielkie dodatki kwasów i zasad. Są to przeważnie roztwory słabych kwasów i ich soli lub słabych zasad i ich soli.
Równanie Arrheniusa - podaje zależność stałej szybkości reakcji chemicznej od temperatury:
![]()
Równanie Debye’a-Hückla-Onsagera - podaje zależność przewodnictwa równoważnikowego od stężenia elektrolitu:
![]()
Stałe A i B są
zależne od rodzaju rozpuszczalnika. Wartość
![]() ,
którą można uzyskać przez ekstrapolację równania do stężenia równego
zeru (rozcieńczenia nieskończenie wielkiego
,
którą można uzyskać przez ekstrapolację równania do stężenia równego
zeru (rozcieńczenia nieskończenie wielkiego
![]() ),
nosi nazwę granicznego przewodnictwa równoważnikowego.
),
nosi nazwę granicznego przewodnictwa równoważnikowego.
Równanie kinetyczne
- podaje wpływ stężenia reagentów
![]() na
szybkość reakcji chemicznej:
na
szybkość reakcji chemicznej:
![]()
gdzie wartość k jest stałą
szybkości reakcji, natomiast
![]() współczynnikiem
stechiometrycznym reagenta i.
współczynnikiem
stechiometrycznym reagenta i.
Równanie stanu - równanie wiążące parametry wyznaczające stan układu. Równanie stanu dla gazu doskonałego wiąże parametry wyznaczające stan gazu – liczbę moli n, ciśnienie p, objętość V i temperaturę T – w jedną zależność:
![]()
Równanie stanu dla gazu rzeczywistego (równanie Van der Waalsa) -
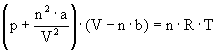
Wyraz
![]() oznacza
korektę ciśnieniową, gdzie n jest liczbą moli, V – objętością,
a - stałą charakterystyczną dla danego gazu. Poprawka n·b
związana jest z objętością własną cząsteczek.
oznacza
korektę ciśnieniową, gdzie n jest liczbą moli, V – objętością,
a - stałą charakterystyczną dla danego gazu. Poprawka n·b
związana jest z objętością własną cząsteczek.
Równanie Schrödingera -
![]()
w którym:
![]() -
funkcja falowa
-
funkcja falowa
m – masa
h – stała Plancka
E – energia
V – energia potencjalna
Funkcja falowa ![]() jest
amplitudą prawdopodobieństwa w punkcie przestrzeni określonym współrzędnymi
x, y, z. W przypadku elektronu funkcja falowa
jest
amplitudą prawdopodobieństwa w punkcie przestrzeni określonym współrzędnymi
x, y, z. W przypadku elektronu funkcja falowa ![]() określa
zatem prawdopodobieństwo znalezienia tej cząstki w określonym miejscu
przestrzeni wokół atomu, a także określa najbardziej prawdopodobne wartości
jego energii.
określa
zatem prawdopodobieństwo znalezienia tej cząstki w określonym miejscu
przestrzeni wokół atomu, a także określa najbardziej prawdopodobne wartości
jego energii.
Ruch jednostajny - ruch prostoliniowy z jednakową prędkością
Rząd reakcji - suma współczynników stechiometrycznych substancji reagujących
(substratów) ![]() .
Rząd reakcji określa jej cząstęczkowość – ilość cząsteczek reagentów
uczestniczących w reakcji.
.
Rząd reakcji określa jej cząstęczkowość – ilość cząsteczek reagentów
uczestniczących w reakcji.
Siła elektromotoryczna ogniwa SEM - różnica potencjałów pomiędzy elektrodami ogniwa.
Siły dyspersyjne Londona - oddziaływanie pomiędzy cząsteczkami (atomami) nie polarnymi wywołane tworzeniem „chwilowych” dipoli w wyniku fluktuacji rozmieszczenia elektronów w cząsteczce (atomie).
Siły
Van der Waalsa - oddziaływania
międzycząsteczkowe będące wynikiem nierównomiernego rozkładu ładunku w cząsteczkach
i atomach. W szczególności mogą być spowodowane
tworzeniem się: dipoli trwałych –
odziaływanie dipol-dipol![]() ,
indukowanych – odziaływania trwały dipol – dipol indukowany
,
indukowanych – odziaływania trwały dipol – dipol indukowany ![]() oraz
dipol indukowany– dipol indukowany
oraz
dipol indukowany– dipol indukowany
![]() ,
a także chwilowym nierównomiernym rozkładem elektronów w atomie - siły
dyspersyjne Londona.
,
a także chwilowym nierównomiernym rozkładem elektronów w atomie - siły
dyspersyjne Londona.
Siły spójności - wzajemne przyciąganie się cząsteczek tej samej substancji wskutek oddziaływań międzycząsteczkowych
Skraplanie - przemiana fazowa gazu w ciecz.
Smog - to powietrze, przy bezwietrznej pogodzie i braku opadów, zawierające dużą ilość stałych i gazowych zanieczyszczeń, które są ośrodkami kondensacji pary wodnej.
Solwatacja - oddziaływanie cząsteczek lub jonów danej substancji z cząsteczkami rozpuszczalnika w wyniku czego powstaje solwatowana forma cząsteczki (jonu). Forma ta jest przeważnie strukturą przestrzenną w której cząsteczka (jon) są otoczone ściśle zorientowanymi cząsteczkami rozpuszczalnika.
Spektroskopia – technika pomiarowa pozwalająca określić budowę i stężenie związku chemicznego na podstawie jego widma
Stała Boltzmanna k - jedna z podstawowych stałych fizycznych, wspólczynnik występujący w rozkładzie Boltzmanna. Rozkład ten przedstawia prawdopodobieństwo (p) znalezienia cząsteczki w stanie, którego energia wynosi E:
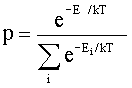
gdzie Ei oznacza energię poszczególnych stanów układu.
Stała
Boltzmanna k wynosi
![]() .
.
Stała dielektryczna - charakterystyka właściwości dielektrycznych substancji
Stała
dysocjacji - stała równowagi
reakcji dysocjacji. Dla reakcji:
![]() można
ją opisać równaniem:
można
ją opisać równaniem:
![]()
Stała Faradaya - ładunek elektryczny, wynoszący 96 500 C, potrzebny do otrzymania 1 gramorównoważnika substancji w trakcie elektrolizy
Stan gazu doskonałego - teoretyczna koncepcja gazu składającego się z punktów materialnych nie oddziaływujących ze sobą
Stała gazowa R - jest to iloczyn stałej Boltzmanna k i liczby Avogadro N:
![]()
Stałą R można obliczyć z równania stanu dla jednego mola gazu doskonałego w warunkach normalnych:
![]()
Stan ciekły - stanem ciekłym nazywamy układ cząsteczek (atomów) w którym oddziaływania międzycząsteczkowe są na tyle istotne, że zbiorowisko cząsteczek dąży do wypełnienia możliwie najmniejszej objętości. Powstaje układ ograniczony w przestrzeni wyraźną granicą fazową w obrębie którego cząsteczki (atomy) są w ciągłym ruchu. Ruch pojedynczej cząsteczki nie jest jednak zupełnie niezależny jak w stanie gazowym. Powstają bliskie strefy wzajemnego uporządkowania (domeny) w których cząsteczki (atomy) zachowują stałe odległości.
Stan gazowy - substancja występuje w stanie gazowym gdy jej atomy lub cząsteczki poruszają się swobodnie bez wzajemnego oddziaływania. Niezależny ruch cząstek powoduje ekspansję gazu prowadzącą do całkowitego wypełnienia naczynia do którego został wprowadzony.
Stany skupienia materii - w zależności od sił wzajemnego przyciągania powstają różne stopnie uporządkowania atomów (cząsteczek), które umownie nazywamy stanami skupienia. Rozróżniamy trzy podstawowe stany skupienia: gazowy, ciekły i stały.
Stechiometria - dział chemii obejmujący obliczenia chemiczne związane z przebiegiem reakcji chemicznych i składem substancji chemicznych
Stężenie procentowe (w procentach masowych) - podaje liczbę jednostek masowych substancji zawartych w 100 jednostkach masowych roztworu:
![]()
![]() - masa substancji rozpuszczonej, [g], [kg],
- masa substancji rozpuszczonej, [g], [kg],
![]() - masa roztworu, [g], [kg],
- masa roztworu, [g], [kg],
![]() - masa rozpuszczalnika, [g], [kg].
- masa rozpuszczalnika, [g], [kg].
Stężenie molarne - wyraża liczbę moli substancji rozpuszczonej w 1 kg rozpuszczalnika:
![]() ,
,
![]()
![]() - liczba moli substancji
rozpuszczonej, [mol],
- liczba moli substancji
rozpuszczonej, [mol],
![]() - masa rozpuszczalnika, [kg],
- masa rozpuszczalnika, [kg],
![]() - masa substancji rozpuszczonej, [g],
- masa substancji rozpuszczonej, [g],
![]() - masa molowa substancji rozpuszczonej,
- masa molowa substancji rozpuszczonej,
![]()
Stężenie molowe - określa
liczbę moli substancji rozpuszczonej, zawartej w
![]() roztworu:
roztworu:
![]()
![]() - liczba moli substancji rozpuszczonej, [mol],
- liczba moli substancji rozpuszczonej, [mol],
![]() - masa substancji rozpuszczonej, [g],
- masa substancji rozpuszczonej, [g],
![]() - masa molowa substancji
rozpuszczonej, [g/mol].
- masa molowa substancji
rozpuszczonej, [g/mol].
Stężenie
normalne - określa liczbę gramorównoważników
(wali) substancji rozpuszczonej, zawartej w
![]() roztworu:
roztworu:
![]() ,
,
![]()
![]() - liczba gramorównoważników substancji rozpuszczonej, [wal],
- liczba gramorównoważników substancji rozpuszczonej, [wal],
![]() - objętość roztworu,
- objętość roztworu,
![]() ,
,
![]() - masa substancji rozpuszczonej, [g],
- masa substancji rozpuszczonej, [g],
![]() - gramorównoważnik substancji rozpuszczonej,
- gramorównoważnik substancji rozpuszczonej,
![]() .
.
Stężenie procentowe objętościowe - podaje liczbę jednostek objętości substancji rozpuszczonej, zawartej w 100 jednostkach objętości roztworu.
![]()
![]() - objętość substancji
rozpuszczonej,
- objętość substancji
rozpuszczonej,
![]() ,
,
![]() - objętość roztworu,
- objętość roztworu,
![]() ,
,
![]() - objętość rozpuszczalnika,
- objętość rozpuszczalnika,
![]() .
.
Stopień dysocjacji:
stopniem dysocjacji
nazywamy stosunek ilości cząsteczek substancji które rozpadły się na jony
do całkowitej (rozpuszczonej) ilości cząsteczek:
![]()
Jeśli ilość cząsteczek
zastąpimy ilością moli n to mamy:
![]()
Stopień dysocjacji
jest liczbą bezwymiarową mieszczącą się w przedziale
![]() . Można go również wyrazić w procentach:
. Można go również wyrazić w procentach:
![]()
stopień utlenienia - dodatnia lub ujemna
liczba będąca hipotetycznym ładunkiem atomu, który istniałby, gdyby cząsteczka
w skład, której wchodzi atom zbudowana byłaby z jonów.
Sublimacja - przemiana fazowa ciała stałego w gaz.
Szybkość reakcji chemicznej
-
![]() można
zdefiniować jako zmianę stężenia produktów lub substratów w czasie:
można
zdefiniować jako zmianę stężenia produktów lub substratów w czasie:
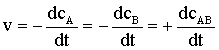
środki powierzchniowo-czynne – substancje obniżające napięcie powierzchniowe roztworu.
Temperatura krytyczna Tk - temperatura powyżej której gaz nie może ulec skropleniu bez względu na stosowane ciśnienie.
Temperatura wrzenia - temperatura w której zachodzi wrzenie. Zależy ona od ciśnienia zewnętrznego.
Teoria kompleksu aktywnego
(stanu przejściowego) - Teoria która mówi,że reakcja
chemiczna będąca wynikiem zderzeń cząsteczek (drobin) zachodzi przy współudziale
nietrwałego przejściowego układu tzn. kompleksu aktywnego. Każde zderzenie
chemicznie efektywne przebiega przez stadium pośrednie o bardzo krótkim czasie
życia (![]() )
)
Teoria zderzeń - Według tej teorii tylko zderzenia cząsteczek o energii równej lub większej niż pewna „progowa” energia zwana energią aktywacji prowadzą do reakcji chemicznej i powstania nowej molekuły (zderzenia „aktywne”).
Topnienie - przemiana fazowa ciała stałego w ciecz.
Układ okresowy pierwiastków - układ grupujący, w odpowiedni sposób, pierwiastki chemiczne ułożone według wzrastających liczb atomowych. Pierwszą wersję układu okresowego przedstawił D.I. Mendelejew w 1869 r.
Ułamkek molowy xi - składnika „i” jest to ilość moli tego składnika ni podzielona przez sumę ilości moli wszystkich składników tworzących
układ ![]() :
:
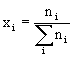
Uporządkowanie
bliskiego zasięgu - cecha amorficznych ciał stałych o chaotycznym
rozmieszczeniu atomów, jakie ma miejsce np. w: szkłach krzemianowych, szkłach
organicznych lub metalicznych.
Uporządkowanie dalekiego zasięgu - cecha struktury ciał krystalicznych przejawiająca
się regularną budową
Utlenianie - reakcja w wyniku której substancja traci (oddaje) elektrony.
Wartościowość - liczba określająca zdolność atomu pierwiastka do przyłączania innych jednowartościowych atomów
Warunki normalne - są to następujące warunki ciśnienia, objętości i temperatury dla stanu gazowego:
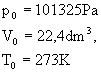
Węglowodory - Związki organiczne składające się z węgla i wodoru. W zależności od budowy można wyróżnić łąńcuchowe (nasycone i nienasycone) i aromatyczne.
Węglowodory alifatyczne - węglowodory łańcuchowe, w których atomy węgla tworzą łańcuchy proste lub rozgałęzione. Mogą być nasycone (alkany) lub nienasycone (np. alkeny, alkiny) zawierając jedno lub więcej wiązań podwójnych lub potrójnych.
Węglowodory
aromatyczne - węglowodory
zawierające w cząsteczce jeden lub więcej pierścieni aromatycznych
(struktura cykliczna ze zdelokalizowanymi elektronami
![]() ),
najczęściej zawierających sześć atomów węgla.
),
najczęściej zawierających sześć atomów węgla.
Wiązanie chemiczne - charakterystyczne oddziaływanie między atomami prowadzące do powstania trwałych układów chemicznych: cząsteczek, jonów lub rodników.
Wiązanie heteropolarne (jonowe) - Wiązanie chemiczne , w którym istotną rolę odgrywa przyciąganie elektrostatyczne jonów utworzonych w czasie przejścia elektronu walencyjnego (jednego lub kilku) od atomu mniej elektroujemnego do bardziej elektroujemnego. Przyjmuje się, że o charakterze jonowym związku chemicznego można sądzić, gdy różnica w skali elektroujemności Paulinga łączących się pierwiastków jest większa od 1,7. Np. LiF, KCl.
Wiązanie
kowalencyjne (atomowe) - Wiązanie
utworzone przez uwspólnienie pary elektronowej (jednej lub kilku) z
wytworzeniem trwałej struktury dubletu lub oktetu. Pierwiastki, których atomy
tworzą wiązania kowalencyjne, charakteryzują się niewielką różnicą w
skali elektroujemności Paulinga. Np. ![]() .Gdy
różnica zawarta jest w przedziale <0,4 - 1,7> mówi się o wiązaniu
atomowym spolaryzowanym. Np.
.Gdy
różnica zawarta jest w przedziale <0,4 - 1,7> mówi się o wiązaniu
atomowym spolaryzowanym. Np.
![]() ,
lub wiązanie H-O w cząsteczce wody.
,
lub wiązanie H-O w cząsteczce wody.
Wiązanie
donorowo- akceptorowe (koordynacyjne) - Szczególny
przypadek wiązania kowalencyjnego, w którym wiążącą parę elektronową
dostarcza jeden z atomów. Dochodzi do skutku gdy jeden z atomów lub grup atomów
(donor) ma wolną parę elektronową, a inny atom (akceptor) ma niezapełnione
orbity elektronowe. Np. wiązanie z czwartym atomem wodoru w jonie
![]() lub
związkach kompleksowych:
lub
związkach kompleksowych:
![]() ,
,
![]()
Wiązanie wodorowe (mostki wodorowe) - oddziaływanie pomiędzy kowalentnie związanym atomem wodoru, a elektroujemnymi atomami sąsiedniej, lub tej samej cząsteczki.
Widmo spektralne (widmo, spektrum) - wykres charakteryzujący natężenie promieniowania elektromagnetycznego emitowanego lub absorbowanego przez substancję. W zależności od rodzaju użytego promieniowania rozróżnia się widmo w podczerwieni (IR), świetle widzialnym (VIS) lub nadfiolecie (UV).
Własności
półprzewodnikowe - właściwości pewnej grupy ciał stałych, dla których
przeniesienie elektronu z pasma podstawowego (walencyjnego) do pasma
przewodnictwa jest porównywalna z energią termiczną i wynosi od 0,1 do 4 eV.
Przewodnictwo odbywa się bądź poprzez przemieszczanie się luki elektronowej
(diurowe) i elektronowe (wywołane transportem elektronów). Wynosi one dla półprzewodników
od 10-9 do 102
![]() . Własności półprzewodnikowe ciał stałych mogą być wywołane przez
wprowadzenie odpowiednich dodatków pierwiastków mogących dostarczać
elektrony do pasma przewodnictwa (półprzewodniki typu n) lub generować luki
elektronowe w paśmie walencyjnym (półprzewodniki typu p).
. Własności półprzewodnikowe ciał stałych mogą być wywołane przez
wprowadzenie odpowiednich dodatków pierwiastków mogących dostarczać
elektrony do pasma przewodnictwa (półprzewodniki typu n) lub generować luki
elektronowe w paśmie walencyjnym (półprzewodniki typu p).
Wodorki - połaczenia metali i niemetali z wodorem
Wskaźniki (indykatory) - są to przeważnie słabe kwasy lub zasady organiczne, których cząsteczka w postaci niezdysocjowanej ma inne zabarwienie niż powstający w wyniku dysocjacji produkt. Służą do oceny pH roztworu na podstawie zmiany zabarwienia indykatora.
Współczynniki stechiometryczne - współczynniki, które należy dobrać podczas uzgadniania równania chemicznego
Zderzenia „aktywne” - zderzenia cząsteczek o energii równej lub większej niż pewna „progowa” energia zwana energią aktywacji prowadzą do reakcji chemicznej i powstania nowej molekuły.
Zderzenia sprężyste (cząsteczek, atomów) - wzajemne zderzenia, lub zderzenia cząsteczek ze ścianami naczynia w których nie ma straty energii. Energia pomiędzy zderzającymi się cząsteczkami może być wymieniana lecz suma energii przed kolizją i po kolizji jest taka sama. Cząsteczki gazu ulegające zderzeniom sprężystym są wolne od oddziaływań międzycząsteczkowych.
Związki amfoteryczne - wodorotlenki i tlenki pewnej grupy pierwiastków, które mają zdolność reagowania z mocnymi kwasami i mocnymi zasadami. Wodorotlenki tych metali w roztworach mocnych kwasów przejawiają właściwości słabych zasad, a w roztworach mocnych zasad są słabymi kwasami. Właściwości amfoteryczne posiadają niektóre metale grup głównych i przejściowych takie, jak np.: glin, cyna, ołów, arsen, antymon, cynk, chrom, mangan.
Związki
kompleksowe - Związki
o złożonej budowie, składające się z atomu centralnego i otaczających go
atomów lub grup atomów zwanych ligandami. Atomem centralnym jest zwykle atom
lub jon o strukturze elektronowej umożliwiającej przyjęcie par elektronowych
i wytworzenie wiązania koordynacyjnego.
Ligandami są cząsteczki lub jony dysponujące wolnymi parami elektronów, które
odgrywają rolę donorów par elektronowych. Związkiem kompleksowym jest np.
heksacyjanożelazian(II) potasu ![]() .
Atomem (jonem) centralnym jest żelazo, które jest otoczone ligandami –
jonami cyjankowymi
.
Atomem (jonem) centralnym jest żelazo, które jest otoczone ligandami –
jonami cyjankowymi ![]() .
W wyniku utworzenia związku kompleksowego atom centralny uzyskuje konfiguracje
elektronową najbliższego gazu szlachetnego (lub zbliżoną). Liczbę ligandów
w cząsteczce podaje liczba koordynacyjna.
.
W wyniku utworzenia związku kompleksowego atom centralny uzyskuje konfiguracje
elektronową najbliższego gazu szlachetnego (lub zbliżoną). Liczbę ligandów
w cząsteczce podaje liczba koordynacyjna.
Związki niestechiometryczne - związki o zmiennym składzie. Odstępstwo od składu stechiometrycznego może być związane z defektami struktury.