3.2. Energia jonizacji
- Minimalna energia potrzebna do
oderwania elektronu z obojętnego atomu lub cząsteczki w stanie podstawowym - I energią jonizacji.
- Jest miarą zdolności atomów do
tworzenia kationów.
- Zależy od najważniejszych wielkości
charakteryzujących atom.
- Wyznacza się na podstawie pomiarów
spektroskopowych i wyraża w eV/atom
lub kJ/mol.
- O energii jonizacji decydują siły,
które w atomie działają na elektrony walencyjne. Zależą
one
przede wszystkim od odległości elektronu od jądra oraz od
efektywnego ładunku jądra.
- II energia jonizacji to
najmniejsza ilość energii potrzebna do oderwania jednego elektronu od jednododatniego jonu.
- III energia jonizacji i kolejne
EI <
EII < EIII < … < En
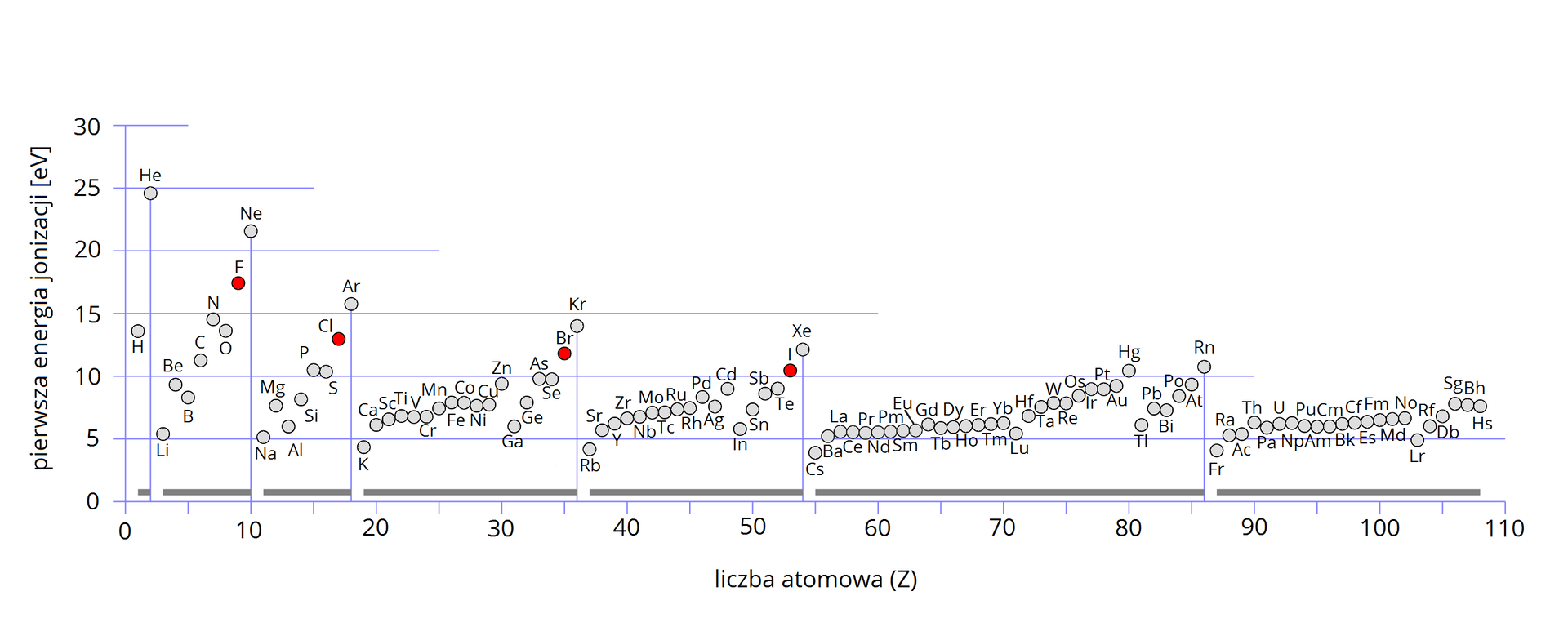
Grafika: Wykres przedstawiający wartości pierwszej energii jonizacji atomów pierwiastków chemicznych w zależności od ich liczby atomowej*.
Źródło: Sponk, zmienione, dostępny w internecie: commons.wikimedia.org, licencja CC BY 3.0.
- W poszczególnych okresach układu
okresowego najmniejsze wartości przyjmuje energia jonizacji pierwiastków o
największym promieniu atomowym → litowców → w miarę zwiększania się liczby
elektronów obserwujemy wzrost energii jonizacji do maksimum dla pierwiastków na
końcu okresu → helowców.
- W obrębie poszczególnych grup
układu okresowego stwierdzamy wyraźne zmniejszenie energii jonizacji, w miarę
wzrostu liczby atomowej →
wzrost promienia atomowego.

Ikona (źródło): Reshot

