1.2 Elektronowa struktura atomów
W każdym
obojętnym atomie ilość elektronów równa jest liczbie atomowej, a więc
równa jest ilości protonów w jądrze. Uwzględniał to już pierwszy
model struktury atomu przedstawiony przez Thompsona na początku XX wieku.
Kolejny to model E. Rutherforda, w którym elektrony o ładunku ujemnym
otaczają dodatnio naładowane jądra. Rutherford ustalił, że jądro
zawiera praktycznie całą masę atomu (rys. 3) oraz ocenił jego średnicę.
Udowodnił eksperymentalnie, że odległość między jądrem a
elektronami jest na tyle duża, że mogą ją bez przeszkód pokonać dość
duże cząstki. Model Rutherforda wyjaśniał niektóre właściwości
materii, m.in. pozwalał wytłumaczyć, dlaczego podczas bombardowania
cienkich blaszek metalowych promieniami 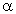 (jądrami atomów He) znaczna ich część nie jest zatrzymywana i
przechodzi przez blaszkę bez zmiany toru ruchu. Z niewielkiej liczby
odbitych cząstek
(jądrami atomów He) znaczna ich część nie jest zatrzymywana i
przechodzi przez blaszkę bez zmiany toru ruchu. Z niewielkiej liczby
odbitych cząstek 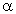 od jąder metalu wnioskował o wielkości jądra atomu.
od jąder metalu wnioskował o wielkości jądra atomu.
