1.3 Kwantowy model atomu Bohra
Dalszy rozwój teorii budowy i struktury atomu jest zasługą N. Bohra. Bohr analizował promieniowanie emitowane przez atomy pobudzone bodźcami fizycznymi takimi, jak: wysoka temperatura lub łuk elektryczny. Wzbudzone w ten sposób atomy wysyłają promieniowanie, które można zobaczyć przy pomocy metod analizy spektroskopowej.
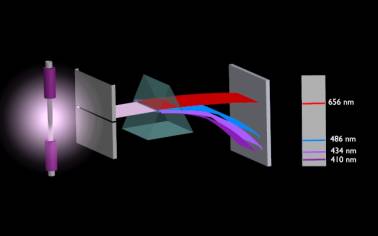
Rysunek 4. Analiza spektroskopowa.
Promieniowanie jest charakterystyczne dla danego rodzaju atomów. Nosi nazwę widma i składa się z pasm promieniowania o określonej długości fali, co w świetle widzialnym można zobaczyć jako oddzielne pasma o różnej barwie.
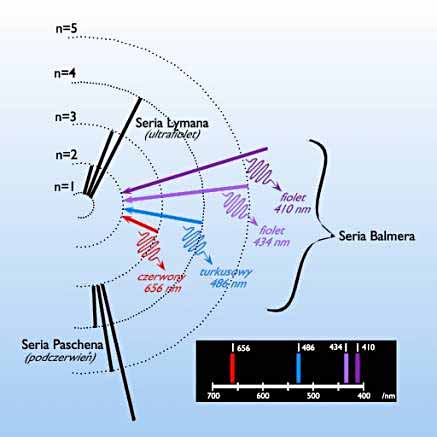
Rysunek 5. Widmo atomu wodoru.
Na podstawie widma atomu wodoru, przedstawionego na rys. 5, można stwierdzić, że wzbudzony atom wysyła jedynie pewne długości światła. Widmo to nie jest ciągłe, jest dyskretne – przyjmuje jedynie niektóre wartości długości fal. Bohr dostrzegł, że stosowanie dotychczasowej teorii elektrodynamiki C. Maxwella nie pozwala wytłumaczyć nieciągłości widma atomowego. Do tej pory bowiem teoria budowy atomu dopuszczała, by elektrony poruszały się wokół atomu na orbitach o dowolnych promieniach. Zatem przejście elektronu z jednej na inną orbitę prowadziłaby do emisji lub absorpcji promieniowania o dowolnej długości fali tworząc widmo ciągłe. Dodatkowo, zgodnie z zasadami klasycznej elektrodynamiki, elektrony musiałyby tracić energię, co z kolei powodowałoby zmniejszanie się promienia orbity elektronu i w efekcie jego spadek na powierzchnię jądra. Atomy takie musiałyby być nietrwałe.
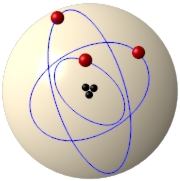
Prace M. Plancka nad kwantową teorią światła, zakładającą istnienie kwantów – ściśle określonych porcji energii, spowodowały, że Bohr przyjął założenie o istnieniu w atomach jedynie ściśle określonych orbit elektronowych zwanych dozwolonymi lub stacjonarnymi. Orbity stacjonarne to specjalne orbity wokół jądra, na których elektrony poruszają się bez utraty energii (rys. 6).
Kliknij na rysunek aby zobaczyć animacje.
Rysunek 6. Model atomu Bohra.
Postulat ten jest równoznaczny z kwantowaniem momentu pędu elektronu, a więc z przyjmowaniem ściśle określonych wartości przez moment pędu elektronu, co można zapisać w postaci równania:
![]() Równanie 1-3
Równanie 1-3
w którym:
m – masa elektronu,
v – prędkość elektronu na orbicie,
r – promień orbity,
n – numer orbity, przy czym n = 1, 2, 3 ...
h – stała Plancka równa 6,625 * 10-34 J* s.
Nastepny postulat Bohra dotyczył przejścia elektronu z jednej orbity stacjonarnej na inną. Zgodnie z nim podczas zmiany orbity przez elektron atom pochłania lub emituje kwant energii (foton):
![]() 1-4
1-4
w którym
h - stała Plancka
![]() - częstość promieniowania.
- częstość promieniowania.
Stan stacjonarny atomu, w którym elektron porusza się po orbicie o najniższej energii, to stan podstawowy atomu. Na podstawie pierwszego postulatu oraz w oparciu o warunek równowagi przyciągania elektrostatycznego (proton-elektron) i siły odśrodkowej działającej na elektron N. Bohr obliczył parametry ruchu elektronu: energię, prędkość, promień jego orbity oraz częstotliwości światła emitowanego przez wzbudzony atom wodoru. Obliczone wartości były zgodne ze znanymi z dużą dokładnością. Dzięki swej teorii prawidłowo przewidział, że w ultrafioletowej części widma istnieją określone długości fal, które dotychczas nie zostały stwierdzone doświadczalnie. Sukces teorii Nielsa Bohra (1913 r.), laureata Nagrody Nobla z 1922 r., polegał na wyjaśnieniu i ilościowej interpretacji widm atomu wodoru. Niedostatek był związany z trudnościami w interpretacji atomów wieloelektronowych. Wyjaśnienie tych problemów podała następna teoria – mechanika kwantowa.