1.4.1 Falowy charakter cząsteczek
Zależność między korpuskularną i falową naturą cząstek podał L. de Broglie:
![]() 1-5
1-5
przypisując
długość fali ![]() cząstkom o pędzie p.
cząstkom o pędzie p.
Na podstawie równania de Broglie’a strumieniowi elektronów o prędkości 5,94 * 108 cm/s można przypisać długość fali równą 1,22*10-8 cm, a więc leżącą w obszarze charakterystycznym dla promieni Roentgena (10-6 – 10-10 cm). Wyjaśnia to podobieństwo rentgenogramów i dyfraktogramów elektronowych.
W tym miejscu trzeba dodać, że arbitralnie przyjęty postulat Bohra dotyczący kwantowania momentu pędu elektronu można było teraz wyprowadzić przypisując elektronom odpowiednią długość fali. Przypisana długość fali powinna być taka, by jej całkowita wielokrotność była równa długości orbity elektronu poruszającego się po orbicie kołowej wokół jądra (rys. 7).
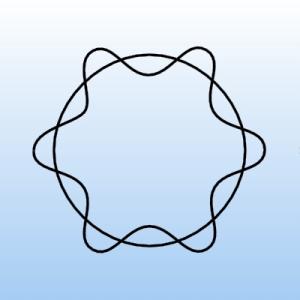
Rysunek 7. Schematyczne przedstawienie ruchu elektronu wokół jądra jako fali.
Przyjęte założenie można zapisać w postaci równania:
![]() 1-6
1-6
w którym:
n - liczba naturalna będąca kolejnym numerem orbity elektronu
![]() - długość fali,
- długość fali,
r – promień orbity kołowej.
Po połączeniu tego warunku ze wzorem de Broglie’a otrzymujemy matematyczny zapis postulatu Bohra (wzór 1-2).