2. Układ okresowy pierwiastków
Pierwiastki chemiczne można ułożyć w pewien sposób zgodnie z rosnącą liczbą atomową tworząc układ okresowy pierwiastków. Pierwszej udanej próby stworzenia takiego układu, w czasach, gdy nie była znana teoria budowy atomu (1869 r.), dokonał D. Mendelejew, wykorzystując okresowo pojawiające się podobieństwo fizycznych i chemicznych właściwości pierwiastków. Współczesny układ okresowy zbudowany na podstawie wiedzy z zakresu budowy atomu przedstawiono w tabeli 4 .
Układ okresowy to uporządkowane zestawienie pierwiastków przedstawione w postaci 18 kolumn zwanych grupami i 7 rzędów zwanych okresami. W kolumnach, ponumerowanych kolejnymi liczbami arabskimi, zgrupowane są pierwiastki o podobnej konfiguracji zewnętrznych powłok elektronowych. Nazwę grupie nadaje pierwszy pierwiastek (wyjątek stanowi wodór). Zatem wyróżnia się grupy: litowców, skandowców, chromowców, grupę żelaza, fluorowców czy helowców.
Zwraca uwagę fakt, że za pomocą przedstawionego układu można łatwo podać konfigurację elektronową atomów pierwiastków analizując położenie pierwiastka w układzie okresowym. Wartość głównej liczby kwantowej ostatniej orbity określa pozioma współrzędna położenia pierwiastka w układzie okresowym, czyli liczba charakteryzująca okres. Np.: sód leży w układzie okresowym w trzecim okresie, co oznacza, że główna liczba kwantowa powłoki walencyjnej równa jest 3. Jod leży w piątym okresie, zatem główna liczba kwantowa ostatniej powłoki wynosi 5. Pionowa współrzędna układu okresowego wyznacza grupę danego pierwiastka. Przynależność pierwiastka do określonej grupy determinuje liczba elektronów na ostatniej n-tej orbicie. Ściśle odnosi się to do pierwiastków grup głównych (pierwiastki bloku s i p). Elektrony tych powłok decydują o wartościowości pierwiastków w związkach chemicznych i z tego względu nazywane są walencyjnymi. Maksymalna wartościowość pierwiastka jest równa sumie elektronów s i p na powłoce walencyjnej. Pierwiastki grup przejściowych (bloku d) i wewnątrzprzejściowych (bloku f) zapełniają orbitale d i f utrzymując jeden lub dwa elektrony na ostatniej powłoce na orbitalu s. Część elektronów orbitalu (n-1)d może brać udział w tworzeniu wiązań chemicznych. Stąd w przypadku pierwiastków grup przejściowych elektronami walencyjnymi mogą być elektrony ns i (n-1)d, a w przypadku metali wewnątrzprzejściowych elektrony ns, (n-1)d oraz (n-2)f. Konfiguracja elektronów walencyjnych pierwiastków wewnątrzprzejściowych rozbudowujących orbital f jest bardzo zbliżona, co powoduje, że pierwiastki te mają prawie identyczne właściwości chemiczne.
Ważną
wielkością umieszczaną przy symbolu pierwiastka w układzie okresowym
jest masa atomowa pierwiastka. Podaje ona masę danego atomu w
jednostkach mas atomowych (j.m.a.) oznaczanych
skrótem u (od angielskiego słowa unit). Jednostka masy
atomowej u równa jest 1,660*10-24
g. Należy zaznaczyć, że liczba masowa pierwiastka nie jest równa masie
atomowej. Np. liczba masowa helu 4 jest bliska, ale nie jest równa masie
atomu ![]() wyrażonej
w jednostkach masy atomowej, którą określono doświadczalnie na 4,002604
j.m.a. Analizując dane zawarte w układzie okresowym można zauważyć, że
duża część pierwiastków charakteryzuje się masami atomowymi będącymi
liczbami niecałkowitymi. Np. masa atomowa chloru wynosi 35,453 u, a magnezu
24,305 u. Niecałkowite wartości mas atomowych biorą się z faktu występowania
w przyrodzie izotopów[1],
to jest takich odmian pierwiastków, których jądra zawierają różne ilości
neutronów. W przypadku chloru w przyrodzie występują dwa izotopy o
liczbach masowych 35 i 37. Oznacza to, że jądro izotopu
wyrażonej
w jednostkach masy atomowej, którą określono doświadczalnie na 4,002604
j.m.a. Analizując dane zawarte w układzie okresowym można zauważyć, że
duża część pierwiastków charakteryzuje się masami atomowymi będącymi
liczbami niecałkowitymi. Np. masa atomowa chloru wynosi 35,453 u, a magnezu
24,305 u. Niecałkowite wartości mas atomowych biorą się z faktu występowania
w przyrodzie izotopów[1],
to jest takich odmian pierwiastków, których jądra zawierają różne ilości
neutronów. W przypadku chloru w przyrodzie występują dwa izotopy o
liczbach masowych 35 i 37. Oznacza to, że jądro izotopu ![]() zawiera
17 protonów i 18 neutronów, a izotopu
zawiera
17 protonów i 18 neutronów, a izotopu ![]() 17
protonów i 20 neutronów. Obydwie odmiany izotopowe mają oczywiście tę
samą ilość 17 elektronów krążących wokół jądra. Rozpowszechnienie
obu izotopów jest różne i wynosi 74,4 % w przypadku
17
protonów i 20 neutronów. Obydwie odmiany izotopowe mają oczywiście tę
samą ilość 17 elektronów krążących wokół jądra. Rozpowszechnienie
obu izotopów jest różne i wynosi 74,4 % w przypadku![]() oraz
25,6 % w przypadku drugiej odmiany. Masa atomowa jest średnią ważoną
mas atomowych obu odmian izotopowych z uwzględnieniem ich rozpowszechnienia
w przyrodzie. Zwykle wszystkie izotopy oznaczane są tym samym symbolem.
Reguła ta nie dotyczy wodoru, którego izotopy noszą nazwy:
oraz
25,6 % w przypadku drugiej odmiany. Masa atomowa jest średnią ważoną
mas atomowych obu odmian izotopowych z uwzględnieniem ich rozpowszechnienia
w przyrodzie. Zwykle wszystkie izotopy oznaczane są tym samym symbolem.
Reguła ta nie dotyczy wodoru, którego izotopy noszą nazwy:![]() deuter
i
deuter
i ![]() tryt
i niekiedy oznaczane są symbolami D i T. Np. wzór „ciężkiej wody”
– wody zawierającej zwiększoną ilość deuteru zapisywano D2O.
Skład izotopowy pierwiastków ustala się metodą spektrometrii masowej
(rys. 13).
tryt
i niekiedy oznaczane są symbolami D i T. Np. wzór „ciężkiej wody”
– wody zawierającej zwiększoną ilość deuteru zapisywano D2O.
Skład izotopowy pierwiastków ustala się metodą spektrometrii masowej
(rys. 13).
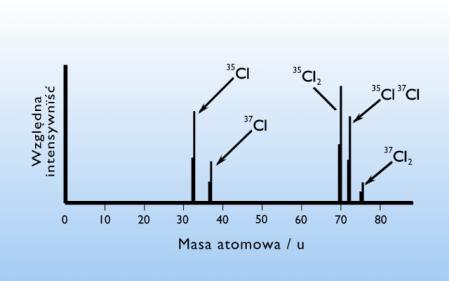
Rysunek 13. Spektrogram mas atomowych chloru.
[1] słowo „izotop” wywodzi się od greckiego isos – ten sam, topos – miejsce, co podkreśla te same właściwości chemiczne odmian izotopowych zajmujących to same miejsce w układzie okresowym.