1.5 Konfiguracje elektronowe pierwiastków
Wraz ze wzrostem liczby atomowej pierwiastka wzrasta liczba elektronów. Zajmują one kolejne orbitale zaczynając od najniższych poziomów energetycznych. Kolejność zajmowania poszczególnych poziomów jest następująca: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, co przedstawiono na rys. 12.
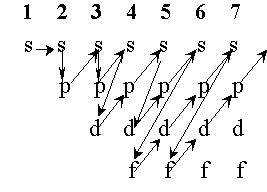
Rysunek 12. Schemat koleiności zapełniania orbitali.
W przypadku cięższych pierwiastków (o większych liczbach atomowych) mogą nastąpić odstępstwa od podanej kolejności wynikające z oddziaływania elektronów między sobą.
Zapisy konfiguracji elektronowych pierwiastków podano w tabeli 3.
Zasadniczo energia elektronów zależy od głównej liczby kwantowej n. Im większa główna liczba kwantowa, tym elektron osiąga wyższą energię. Co prawda orbitale s, p i d różnią się energią, ale decydujące znaczenie ma numer powłoki. Zasada ta jest zachowana na pierwszych trzech poziomach energetycznych atomu. Na wyższych poziomach energetycznych energia elektronów zależy nie tylko od głównej liczby kwantowej, lecz także - i to w istotniejszy sposób niż poprzednio - od pobocznej liczby kwantowej. Wpływ pobocznej liczby kwantowej może być tak duży, że niektóre poziomy energetyczne d lub f o mniejszej głównej liczbie kwantowej będą charakteryzowały się wyższą energią od poziomów o większej głównej liczbie kwantowej. Ma to miejsce np.: w przypadku orbitali 4s - 3d lub 6s – 4f - 5d. Wcześniej zapełnia się orbital 4s niż 3d, 6s niż 4f, mimo iż inaczej to nakazywałaby wartość głównej liczby kwantowej.
W tabeli 3 można zauważyć inne wyjątki od „regularnego” zapełniania orbitali np. w przypadku pierwiastków chromu lub miedzi. Przy rozbudowie powłoki wanadu o konfiguracji1s2 2s2p6 3s2p6d3 4s2 o jeden elektron w miejsce spodziewanej konfiguracji 1s2 2s2p6 3s2p6d4 4s2 pojawia się 1s2 2s2p6 3s2p6d5 4s1 co wynika z korzystniejszej sytuacji energetycznej.
Kolejność zapełniania orbitali zdegenerowanych jest zgodna z regułą Hundta, która mówi, że pary elektronowe na tych orbitalach pojawiają się dopiero po zapełnieniu wszystkich orbitali zdegenerowanych przez pojedyncze elektrony. Spiny tych niesparowanych elektronów są jednakowe.
Np. w przypadku orbitalu d, na którym może zmieścić się 10 elektronów, pierwsze pięć elektronów będzie zajmowało kolejno wolne orbitale pozostając niesparowanymi
![]()
Dopiero dalsze elektrony zajmują wolne miejsca tworząc pary np. szósty elektron:
![]()
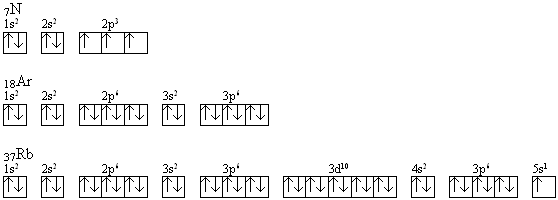
Przykładowe zapisy konfiguracji elektronowych za pomocą wzorów klatkowych: