3.3.1 Teoria orbitali molekularnych
Zakłada się w niej, że orbital cząsteczkowy powstaje w wyniku nakładania się orbitali atomowych atomów tworzących wiązanie. Pozwala to traktować funkcję falową elektronu w cząsteczce jako liniową kombinację funkcji falowych opisujących orbitale atomowe:
![]()
W równaniu stałe cA i cB dobrane są tak, by energia orbitalu cząsteczkowego osiągała minimum.
Dla dwuatomowej cząsteczki takich samych atomów typu A2 rozwiązaniem funkcji falowej elektronu w cząsteczce są dwie funkcje własne: orbital wiążący oraz orbital antywiążący. Orbitale te różnią się energią, przy czym orbital wiążący charakteryzuje się mniejszą energią od wyjściowych orbitali atomowych, a orbital antywiążący większą (rys.20).
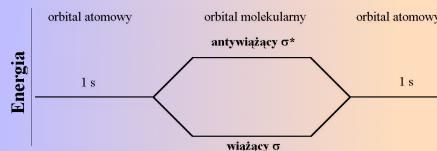
Rysunek 20. Energia orbitali atomowych i molekularnych.
Trwałość wiązania zależy od ilości elektronów na obu typach orbitali. Jeśli ilość elektronów na orbitalach wiążących jest większa od ilości elektronów na orbitalach antywiążących, to wiązanie jest trwałe.
W przypadku
atomów, które tworzą wiązania z udziałem orbitali atomowych s – s, s
- p lub współliniowo leżących orbitali p (py – py;
oś y jest kierunkiem zbliżania się atomów) powstaje wiążący orbital
cząsteczkowy ![]() i antywiążący orbital cząsteczkowy
i antywiążący orbital cząsteczkowy ![]() *.
Orbital wiążący
*.
Orbital wiążący ![]() charakteryzuje się zwiększoną gęstością elektronów w przestrzeni między
jądrami. Para elektronów zajmująca ten orbital nosi nazwę wiążącej i
tworzy trwałe wiązanie. Orbital antywiążący
charakteryzuje się zwiększoną gęstością elektronów w przestrzeni między
jądrami. Para elektronów zajmująca ten orbital nosi nazwę wiążącej i
tworzy trwałe wiązanie. Orbital antywiążący ![]() *
charakteryzuje się mniejszą gęstością elektronów w przestrzeni między
jądrami, co powoduje, że jądra atomów odpychają się. Ilustracją
tworzenia wiązań
*
charakteryzuje się mniejszą gęstością elektronów w przestrzeni między
jądrami, co powoduje, że jądra atomów odpychają się. Ilustracją
tworzenia wiązań ![]() i
i ![]() *
są oddziaływania międzyatomowe w cząsteczce H2 i nie istniejącej
cząsteczce He2. Cząsteczka H2 powstaje w wyniku
utworzenia orbitalu cząsteczkowego
*
są oddziaływania międzyatomowe w cząsteczce H2 i nie istniejącej
cząsteczce He2. Cząsteczka H2 powstaje w wyniku
utworzenia orbitalu cząsteczkowego ![]() z orbitali 1s atomów wodoru. Przez nałożenie się dwu orbitali atomowych
powstają dwa orbitale cząsteczkowe
z orbitali 1s atomów wodoru. Przez nałożenie się dwu orbitali atomowych
powstają dwa orbitale cząsteczkowe ![]() i
i ![]() *.
W cząsteczce wodoru obydwa elektrony obsadzają orbital
*.
W cząsteczce wodoru obydwa elektrony obsadzają orbital ![]() o niższej energii, a orbital
o niższej energii, a orbital ![]() *
pozostaje nie zajęty. W czasie tworzenia wiązania wydziela się energia
(energia wiązania), a układ jest trwały ze względu na uzyskanie
uprzywilejowanego stanu energetycznego charakteryzującego się minimum
energii. Podczas tworzenia się hipotetycznej cząsteczki He2,
powstałyby orbitale cząsteczkowe
*
pozostaje nie zajęty. W czasie tworzenia wiązania wydziela się energia
(energia wiązania), a układ jest trwały ze względu na uzyskanie
uprzywilejowanego stanu energetycznego charakteryzującego się minimum
energii. Podczas tworzenia się hipotetycznej cząsteczki He2,
powstałyby orbitale cząsteczkowe ![]() i
i ![]() *,
które zostałyby zajęte przez cztery elektrony 1s2 obu atomów
helu. Utworzyłby się układ, w którym ilość elektronów na orbitalu wiążącym
i antywiążącym byłaby taka sama. To nie spowodowałoby obniżenia
energii układu, ponieważ suma energii orbitalu
*,
które zostałyby zajęte przez cztery elektrony 1s2 obu atomów
helu. Utworzyłby się układ, w którym ilość elektronów na orbitalu wiążącym
i antywiążącym byłaby taka sama. To nie spowodowałoby obniżenia
energii układu, ponieważ suma energii orbitalu ![]() i
i ![]() *
nie jest mniejsza od sumy energii orbitali atomowych 1s2. Cząsteczka
He2 nie może być trwała, czego skutkiem jest występowanie
helu w postaci atomowej.
*
nie jest mniejsza od sumy energii orbitali atomowych 1s2. Cząsteczka
He2 nie może być trwała, czego skutkiem jest występowanie
helu w postaci atomowej.
Wiązania
chemiczne realizowane za pomocą elektronów orbitali px lub pz
powstające przez boczne nakładanie się tych orbitali (oś y jest
kierunkiem zbliżania się atomów) polegają na utworzeniu się wiążących
i antywiążących orbitali cząsteczkowych ![]() i
i ![]() *.
Z orbitali px dwóch atomów powstają dwa molekularne
orbitale:
*.
Z orbitali px dwóch atomów powstają dwa molekularne
orbitale: ![]() i
i ![]() *.
Podobnie jest w przypadku orbitali pz. Przestrzenny kształt
orbitali wiążących przedstawiono na rys. 21.
*.
Podobnie jest w przypadku orbitali pz. Przestrzenny kształt
orbitali wiążących przedstawiono na rys. 21.
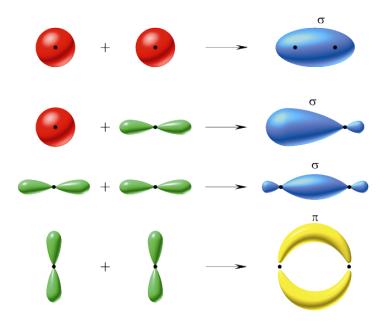
Rysunek 21.
Wiążące orbitale ![]() i
i ![]() .
.
Kolejność zapełniania orbitali molekularnych, wynika z ich energii, która wzrasta zgodnie ze schematem:
![]()