3.3.3 Hybrydyzacja
Rozwój badań strukturalnych pozwolił określić parametry wiązań chemicznych takie, jak odległości międzyatomowe i rozmieszczenie atomów w cząsteczkach. Okazało się, że wiązania chemiczne utworzone przez nakładanie się orbitali atomowych mają często inne usytuowanie w przestrzeni niż to, które wynika z kształtu wyjściowych orbitali atomowych. Kąty między wiązaniami w cząsteczce benzenu lub cząsteczce metanu różnią się od siebie i nie są równe 90° jak by to wynikało z kątów między orbitalami p w atomie węgla. Oznaczone odległości między atomami węgla i wodoru w metanie wykazały, że wszystkie cztery wiązania są jednakowej długości. Stan ten nie wynika bezpośrednio z konfiguracji walencyjnych elektronów węgla s2p2. Atom węgla mając zróżnicowane pod względem energii orbitale s i p powinien tworzyć odmienne typy wiązań chemicznych z udziałem każdego z tych orbitali. Powinien tworzyć wiązania o zróżnicowanej długości i energii. Doświadczenie pokazuje, że tak nie jest. Każdy z atomów wodoru w metanie posiada te same właściwości, każde wiązanie C-H jest równocenne. Oznacza to, że w trakcie tworzenia wiązań chemicznych następują zmiany w konfiguracji elektronowej atomu węgla polegające na ujednorodnieniu orbitali atomowych. Tłumaczy to teoria hybrydyzacji. Podczas tworzenia metanu sytuacja wyjściowa jest następująca: Atom węgla ma konfigurację 1s2 2s2p2:
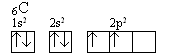
Przy zbliżaniu się do atomu węgla atomów wodoru następuje wzbudzenie atomu węgla polegające na przeniesieniu elektronu 2s na wolne miejsce na orbitalu 2p. Konfigurację elektronową stanu wzbudzonego przedstawia zapis:
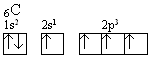
Ta struktura pozwala wytworzyć cztery wiązania za pomocą czterech niesparowanych elektronów, ale nie tłumaczy równocenności wiązań. Między orbitalami s i p zachodzi proces hybrydyzacji (ujednorodnienia, wymieszania) wynikający z korzystnych zmian energetycznych towarzyszących lepszemu usytuowaniu zhydrydyzowanych orbitali sp3 w przestrzeni (rys.23).
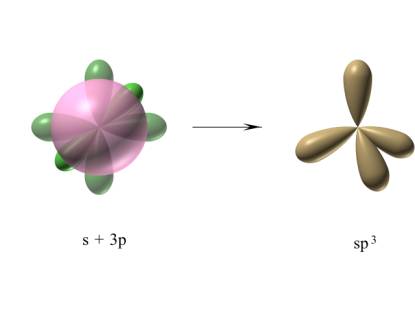
Rysunek 23. Tworzenie się orbitali sp3 przez hybrydyzację orbitalu s i trzech orbitali p.
Konfigurację zhybrydyzowanego orbitalu sp3 przedstawia zapis:
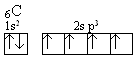
W
tej sytuacji atom węgla może utworzyć cztery jednakowe wiązania, których
kształt przestrzenny oddają linie łączące środek tetraedru (czworościan
regularny) z jego narożami. W środku ciężkości tetraedru znajduje się
atom węgla, który tworzy wiązania za pomocą zhydrydyzowanych orbitali
skierowanych ku czterem narożom tetraedru. Kształt i rozmiar orbitali jest
identyczny, a kąty między nimi są równe i wynoszą 109,5°.
Po utworzeniu czterech wiązań kowalentnych ![]() z czterema atomami wodoru konfiguracja elektronowa atomu węgla przedstawia
się następująco:
z czterema atomami wodoru konfiguracja elektronowa atomu węgla przedstawia
się następująco:
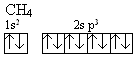
Na tej samej zasadzie, na planie tetraedru, powstają cząsteczki NH3 i H2O, w których atomy azotu i tlenu uległy hybrydyzacji sp3 (rys.24).
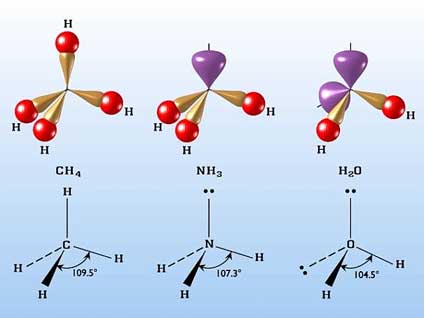
Rysunek 24. Tetraedryczna struktura cząsteczek metanu, amoniaku i wody.
Niektóre nie obsadzone atomami wodoru naroża tetraedru w omawianych związkach zajmują wolne pary elektronowe. W amoniaku jest jedna taka para, a w cząsteczce wody dwie. Obecność wolnych par elektronowych zaburza nieco symetrię cząsteczki wskutek odpychania się elektronów, co powoduje, że kąt między wiązaniami H-N-H wynosi 107,3°, a H-O-H 104,5°. Obecność wolnych par elektronowych wpływa w istotny sposób na właściwości związków chemicznych, bowiem niezrównoważona struktura elektronowa cząsteczki powoduje powstanie momentu dipolowego.
Atom węgla może, oprócz hybrydyzacji sp3, także ulegać hybrydyzacji sp2 i sp (rys.25).
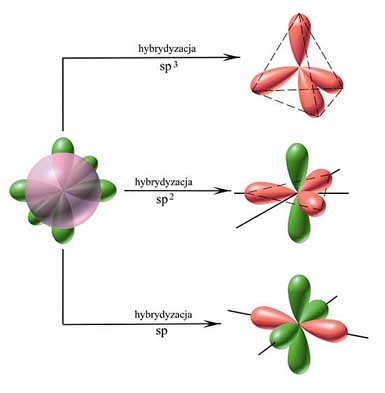
Rysunek 25. Hybrydyzacja sp3, sp2 i sp węgla .
Hybrydyzacja
sp2 polega na wymieszaniu się
orbitalu s z dwoma orbitalami p z wytworzeniem struktury płaskiej (rys.25).
Wiązania wytworzone z udziałem zhybrydyzowanych orbitali sp2 leżą
na jednej płaszczyźnie, a kąt między nimi wynosi 120°
. W cząsteczce etenu C2H4 (etylenu), przedstawionej
na rys.26. atomy węgla wytwarzają za pomocą zhybrydyzowanych orbitali sp2
(kolor czerwony) wiązanie ![]() (kolor niebieski) wiążąc po dwa atomy wodoru i tworząc wiązanie między
sobą, a niezhybrydyzowane orbitale p (kolor zielony) tworzą wiązanie
(kolor niebieski) wiążąc po dwa atomy wodoru i tworząc wiązanie między
sobą, a niezhybrydyzowane orbitale p (kolor zielony) tworzą wiązanie ![]() (kolor żółty). Wszystkie atomy leżą na tej samej płaszczyźnie, a wiązanie
(kolor żółty). Wszystkie atomy leżą na tej samej płaszczyźnie, a wiązanie
![]() usztywnia cząsteczkę uniemożliwiając swobodny obrót wokół wiązania
C-C.
usztywnia cząsteczkę uniemożliwiając swobodny obrót wokół wiązania
C-C.
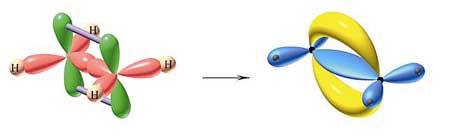
Rysunek 26.
Tworzenie się wiązań ![]() i
i ![]() w cząsteczce etenu H2C=CH2.
w cząsteczce etenu H2C=CH2.
Hybrydyzacja
sp2 występuje także w pierścieniu aromatycznym. W benzenie za
pomocą zhybrydyzowanych orbitali sp2 atom węgla wiąże się sąsiednimi
atomami węgla i z atomem wodoru. Hybrydyzacja sp2 sprawia, że
cząsteczka benzenu jest płaska, zatem wszystkie tworzące ją atomy węgla
i wodoru leżą w jednej płaszczyźnie. Nie biorące udziału w
hybrydyzacji elektrony p każdego atomu węgla tworzą wiązanie ![]() (rys.27). Zdelokalizowany sekstet elektronów
(rys.27). Zdelokalizowany sekstet elektronów ![]() jest odpowiedzialny za charakter aromatyczny połączeń.
jest odpowiedzialny za charakter aromatyczny połączeń.
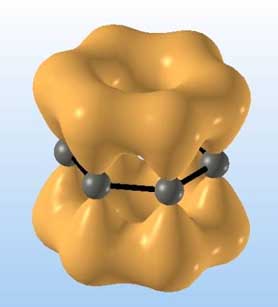
Rysunek 27.
Struktura pierścienia benzenowego, wiązania ![]() i
i ![]() między atomami węgla.
między atomami węgla.
Hybrydyzacja
sp polega na wymieszaniu się orbitalu s z jednym orbitalem p z
wytworzeniem struktury liniowej. Wszystkie wiązania wytworzone z udziałem
zhybrydyzowanych orbitali sp leżą wzdłuż jednej prostej . W cząsteczce
etynu C2H2 (acetylenu), przedstawionej na rys.28 atomy
węgla wytwarzają za pomocą zhybrydyzowanych orbitali sp (kolor czerwony)
wiązanie ![]() (kolor niebieski) wiążąc dwa atomy wodoru i tworząc wiązanie między
sobą, a niezhybrydyzowane dwa orbitale p (kolor zielony) tworzą dwa wiązania
(kolor niebieski) wiążąc dwa atomy wodoru i tworząc wiązanie między
sobą, a niezhybrydyzowane dwa orbitale p (kolor zielony) tworzą dwa wiązania
![]() (kolor żółty). Wiązania
(kolor żółty). Wiązania
![]() usztywniają cząsteczkę uniemożliwiając swobodny obrót wokół wiązania
C-C.
usztywniają cząsteczkę uniemożliwiając swobodny obrót wokół wiązania
C-C.
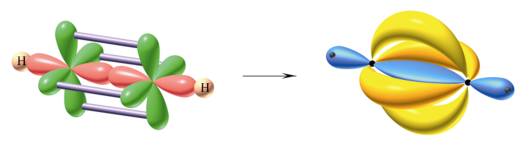
Rysunek
28.
Tworzenie się wiązań ![]() i
i ![]() w cząsteczce etynu
w cząsteczce etynu ![]()