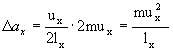2.1.1.2 Ciśnienie gazu
Rys.2.02
przedstawia rozkład prędkości na trzy składowe kierunkowe w układzie
kartezjańskim x,y,z dla cząsteczki gazu o masie m poruszającą
się w jednostce objętości
ograniczonej ścianami naczynia. Jeżeli cząstka taka ulegnie sprężystemu
odbiciu z prostopadłą do kierunku x ścianą nastąpi zmiana zwrotu
prędkości i średni pęd cząsteczki po odbiciu wyniesie
![]() .
.

Rys.2.02. Rozkład składowych prędkości cząsteczki poruszającej się w jednostce objętości.
Zmiana pędu wywołana zderzeniem jest więc równa:
Jeżeli
długość naczynia w kierunku x wynosi
![]() to czas upływający między kolejnymi zderzeniami cząsteczki z ta samą ścianą
wyniesie
to czas upływający między kolejnymi zderzeniami cząsteczki z ta samą ścianą
wyniesie
![]() a częstość zderzeń będzie
jego odwrotnością:
a częstość zderzeń będzie
jego odwrotnością:
![]() .
.
Sumaryczna
zmiana pędu
![]() w jednostce czasu będzie równa
iloczynowi częstości zderzeń i zmiany pędu odpowiadającej pojedynczemu
zderzeniu:
w jednostce czasu będzie równa
iloczynowi częstości zderzeń i zmiany pędu odpowiadającej pojedynczemu
zderzeniu:
Ściana działa na każdą cząstkę siłą F, której bezwzględna wartość jest równa zmianie pędu:
Siła ta odniesiona do i cząstek uderzających o jednostkę powierzchni ściany jest miarą wywieranego przez gaz ciśnienia na ścianę naczynia:
Wykorzystując
geometryczny związek pomiędzy średnią prędkością wypadkową u
a jej składowymi kierunkowymi
![]() względem trzech osi:
względem trzech osi:
oraz zależność:
mamy:
gdzie u2 jest średnim kwadratem prędkości niezależnym od kierunku ruchu.
Podstawiając (2.07) do (2.04 ) otrzymamy:
Ponieważ
iloczyn
![]() jest objętością naczynia
V mamy:
jest objętością naczynia
V mamy:
Równanie
(2.9) wyprowadzone dla gazu doskonałego jest podstawowym równaniem wiążącym
ciśnienie gazu p ze stężeniem cząsteczek wyrażonym przez
![]() oraz ze średnim
kwadratem ich szybkości
oraz ze średnim
kwadratem ich szybkości
![]() . Równanie to można przedstawić w formie iloczynu ciśnienia i objętości:
. Równanie to można przedstawić w formie iloczynu ciśnienia i objętości:
Wprowadzając
do wyrażenia (2.10) liczbę Avogadra
(II.2.1.2.1)
![]() uzyskujemy
wartość
uzyskujemy
wartość
![]() dla n moli gazu:
dla n moli gazu:
gdzie
![]() a masa molowa gazu
M (V.1.3.1) jest równa
iloczynowi
a masa molowa gazu
M (V.1.3.1) jest równa
iloczynowi
![]() .
.