2.1.2.2 Prawo Boyle’a – Mariotte’a. Przemiana izotermiczna.
Iloczyn
ciśnienia i objętości gazu jest wielkością stałą w stałej
temperaturze:
W
stałej temperaturze objętość gazu jest odwrotnie proporcjonalna do ciśnienia.
Rys.2.05 przedstawia zależność wyrażoną równaniem (2.17) – izotermę.
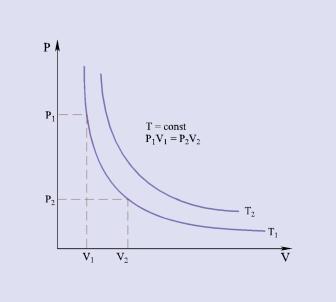
Rys. 2.05. Izotermy p-V dla gazu doskonałego
Przykład
1

Temat: W naczyniu z tłokiem, w stałej temperaturze i pod ciśnieniem 800 hPa znajduje się 300 cm3 gazu. Jak zmieni się objętość tego gazu jeśli ciśnienie zwiększymy do 1000 hPa ?
Rozwiązanie
: Korzystamy
z prawa Boyle’a i Mariotte’a , które mówi :
Nasze
dane :
p1=
800hPa
p2=1000hPa
v1=300
cm3
v2=
?
Po podstawieniu mamy:
Odpowiedź: Objętość gazu będzie wynosiła 240cm3.
Przykład
2

Temat: W warunkach normalnych odmierzono 120 cm3 argonu. Jak musi zmienić się ciśnienie aby objętość tego gazu wzrosła do 150 cm3 ?
Rozwiązanie
: Korzystamy z
prawa Boyle’a i Mariotte’a , które mówi że:
Nasze
dane:
p1=1013,25
hPa
V1=120
cm3
p2=?
V2=150
cm3 po podstawieniu mamy :
Odpowiedź: Ciśnienie wzrośnie do 810,6 hPa.