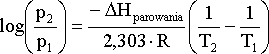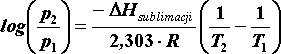2.4.1 Prężność pary nad cieczą. Ciepło parowania.
W zamkniętym naczyniu, napełnionym częściowo cieczą ustala się równowaga pomiędzy cząsteczkami cieczy i tymi samymi cząsteczkami znajdującymi się w stanie gazowym (rys.5.02). Równowaga ma charakter dynamiczny. Cząsteczki opuszczają ciecz i wracają do niej w wyniku ruchów kinetyczno-molekularnych. Ilość cząsteczek biorących udział w tym procesie rośnie wraz z temperaturą i determinuje ciśnienie par gazu nad cieczą.
Ustalone w danej temperaturze ciśnienie gazu nad cieczą nosi nawę prężności pary.
Równowagowe ciśnienie par gazu nad cieczą warunkach gdy szybkość parowania jest równoważna szybkości skraplania nazywamy prężnością pary nasyconej.
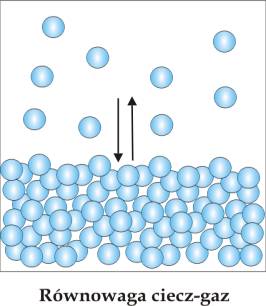
Rys.5.02.
Liczba cząsteczek Np opuszczających ciecz w procesie parowania jest proporcjonalna do liczby cząsteczek cieczy, które osiągnęły energię równą lub większą niż pewna krytyczna energia E* potrzebna do wyrwania cząsteczki z cieczy. Energia ta zależy oczywiście od oddziaływań międzycząsteczkowych danej substancji w stanie ciekłym. Liczbę Np można uzyskać z równania Maxwella-Boltzmanna:
Równanie(5.01)
![]()
Liczba cząsteczek ulegających skropleniu Ns jest proporcjonalna do stężenia cząsteczek w fazie gazowej to znaczy do prężności pary tego gazu p:
Równanie(5.02)
![]()
gdzie Nc i Ng są wielkościami stałymi dla danego gazu.
W
stanie równowagi gdy ilość cząsteczek opuszczających fazę ciekłą
jest równa ilości cząsteczek ulegających skropleniu (
![]() ) mamy:
) mamy:
Równanie(5.03)
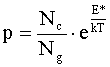
Równanie (5.03) można przedstawić w formie logarytmicznej:
Równanie(5.04)
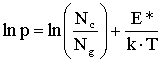
lub
oznaczając
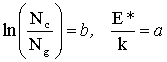
w postaci:
Równanie(5.05)
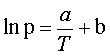
Równanie (5.05) ilustruje zależność prężności pary nasyconej od temperatury.
Tablica 5.1 przedstawia wartości stałych
![]() równania (5.05) dla wybranych
gazów.
równania (5.05) dla wybranych
gazów.
|
Wartości stałych
w ogólnym równaniu prężności pary (5.05). |
||
|
Gaz |
Stała
|
Stała
|
|
|
-339,8 |
7,711 |
|
|
-1530 |
9,950 |
|
He |
-7,978 |
4,729 |
|
|
-1127,1 |
8,84 |
|
|
-662,8 |
6,996 |
|
|
-2534,7 |
8,853 |
|
|
-1031,1 |
7,732 |
|
|
-1055 |
7,431 |
|
|
-1316,8 |
7,374 |
|
|
-1023 |
8,443 |
|
|
-956,3 |
7,517 |
|
|
-1127 |
7,630 |
|
|
-1440 |
7,695 |
|
|
-1335 |
10,382 |
|
|
-1572 |
7,644 |
|
|
-1824,9 |
7,597 |
Prężność pary jest zgodnie z równaniem (5.05) funkcją wykładniczą temperatury co ilustruje rys. 5.03a.
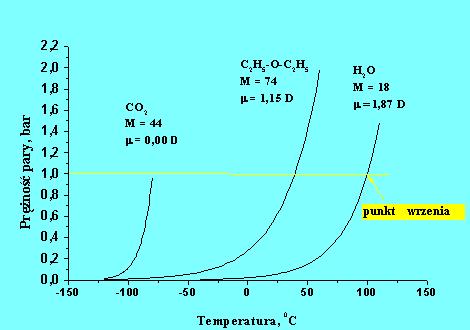
Rys.5.03a. Prężność pary dwutlenku węgla, eteru di-etylowego oraz wody jako funkcja temperatury.
Dane
przedstawione na rysunku (5.03a) oraz w tablicy (5.1) dowodzą, że oddziaływania
międzycząsteczkowe decydują o lotności substancji. Cząsteczki polarne o
dużym momencie dipolowym posiadają dużą ujemną wartość stałej
![]() , a więc trudniej przechodzą w stan gazowy. Funkcja wykładnicza (równanie
5.03) ilustrująca zależność prężności pary nasyconej od temperatury
(rys.5.03a) przesuwa się w miarę wzrostu momentu dipolowego w kierunku wyższych
temperatur. Dwutlenek węgla posiadający moment dipolowym równy zeru jest
bardziej lotny niż woda, której moment dipolowy
wynosi 1,87 D. Pod ciśnieniem atmosferycznym (1,013 bar) temperatura
wrzenia
, a więc trudniej przechodzą w stan gazowy. Funkcja wykładnicza (równanie
5.03) ilustrująca zależność prężności pary nasyconej od temperatury
(rys.5.03a) przesuwa się w miarę wzrostu momentu dipolowego w kierunku wyższych
temperatur. Dwutlenek węgla posiadający moment dipolowym równy zeru jest
bardziej lotny niż woda, której moment dipolowy
wynosi 1,87 D. Pod ciśnieniem atmosferycznym (1,013 bar) temperatura
wrzenia
![]() wynosi –80 0C
podczas gdy woda wrze w temperaturze 1000C.
wynosi –80 0C
podczas gdy woda wrze w temperaturze 1000C.
Zależność prężności pary od temperatury przedstawiona równaniem (5.05) znana jest również pod nazwą równania Clausiusa-Clapeyrona:
i
może służyć do obliczenia prężności pary p2 w
danej temperaturze T2 jeśli znana jest prężność pary p1
w temperaturze T1 oraz znane jest ciepło
parowania ![]() Hpar..
Hpar..
Ciepłem
parowania ![]() Hpar.
nazywamy ilość ciepła potrzebną do przeprowadzenia jednostkowej masy
cieczy (jednego grama lub jednego mola) w parę o tej samej temperaturze.
Hpar.
nazywamy ilość ciepła potrzebną do przeprowadzenia jednostkowej masy
cieczy (jednego grama lub jednego mola) w parę o tej samej temperaturze.
Łatwo
zauważyć, że stała
![]() w równaniu 5.05 zawiera w sobie ciepło parowania
w równaniu 5.05 zawiera w sobie ciepło parowania ![]() Hpar.:
Hpar.:
Równanie(5.07)
![]()
Wartości ![]() Hpar.
można uzyskać z
nachylenia funkcji
Hpar.
można uzyskać z
nachylenia funkcji
![]() (rys.5 03b).
(rys.5 03b).
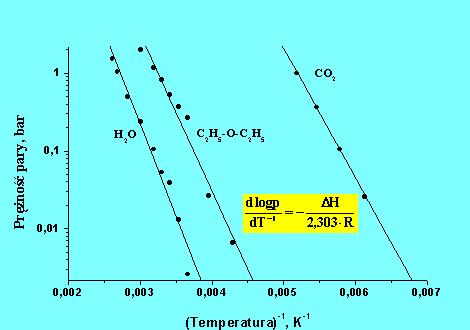
Rys.5.03b. Zależność
![]() dla danych przedstawionych w rys.5.03a.
dla danych przedstawionych w rys.5.03a.
Temperatura wrzenia
Jeśli prężność pary cieczy zrównoważy ciśnienie zewnętrzne następuje zjawisko wrzenia. Parowanie nie jest wtedy zjawiskiem powierzchniowym lecz ma miejsce w całej objętości cieczy co powoduje gwałtowne wydzielanie się gazu – wrzenie cieczy. Temperatura w której zachodzi wrzenie nosi nazwę temperatury wrzenia. Zależy ona od ciśnienia zewnętrznego. Krzywa przedstawiająca zależność prężności pary od temperatury jest równocześnie zależnością temperatury wrzenia od ciśnienia (rys.5.03a).
Sublimacja
Przedstawione zależności prężności pary od temperatury (równania 5.05.i 5.06) można stosować w procesach sublimacji czyli w procesach przejścia ze stanu stałego w gazowy. Ciepło parowania w równaniu (5.06) należy wtedy zastąpić ciepłem sublimacji: