1.2 Szybkość reakcji chemicznej
Reakcje chemiczne są procesami zachodzącymi z określoną szybkością v.
Szybkość reakcji:
można zdefiniować jako zmianę stężenia produktów lub substratów w czasie:
(2.2)
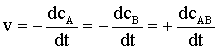
gdzie cA, cB oznaczają stężenia molowe substratów A i B a cAB stężenie molowe produktu AB. Ponieważ w wyniku reakcji stężenie substratów maleje zmiana stężenia w czasie oznaczona jest znakiem ujemnym (-dcA, -dcB). Stężenie produktu rośnie więc zmiana stężenia AB ma znak dodatni (+dcAB).
Oczywiście szybkość reakcji chemicznej niekoniecznie musi być mierzona zmianami stężenia molowego. Można użyć każdego innego sposobu wyrażania ilości substancji reagujących (masę, stężenie molarne, ułamek molowy, ułamek atomowy itp.).
Definicja
wyrażona równaniem (2.2) przedstawia sposób pomiaru szybkości reakcji.
Wystarczy mierzyć odpowiednie stężenia w czasie i wykreślić odpowiednie
zmiany c=f(t). Rys.2.1 przedstawia sposób wyznaczania szybkości
reakcji z danych empirycznych. Szybkość reakcji w danej chwili jest równa
współczynnikowi kierunkowemu stycznej do krzywej c=f(t) w danym
punkcie (c,t) (
![]() ).
).
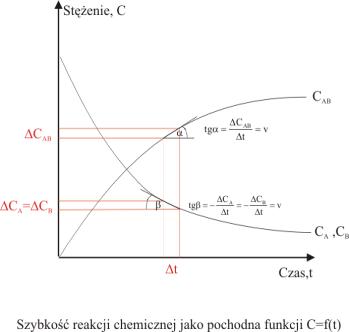
Rys.2.1.
Szybkość reakcji jest cechą charakterystyczną dla danego zespołu reagentów, a ponadto zależy od wielu czynników. Najważniejsze z nich to:
·
stężenie reagentów
·
temperatura
·
ciśnienie (gdy reakcja przebiega w fazie gazowej)
·
promieniowanie elektromagnetyczne (gdy reakcja jest
fotochemiczna)
·
rozwinięcie powierzchni (w przypadku reakcji
powierzchniowych)
·
obecność katalizatora lub inhibitora.