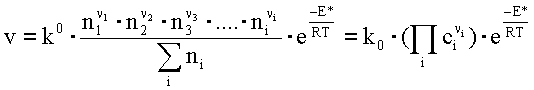1.3 Teoria zderzeń jako statystyczny opis procesu chemicznego. Równanie kinetyczne.
Aby zaszła reakcja (2.1) pomiędzy cząsteczkami A i B musi dojść do ich kolizji (zderzenia). Nie wszystkie jednak zderzenia prowadzą do powstania nowej cząsteczki AB. Tylko zderzenia cząsteczek o energii równej lub większej niż pewna „progowa” energia E* zwana energią aktywacji prowadzą do reakcji chemicznej i powstania nowej molekuły (zderzenia „aktywne”).
Ilość cząsteczek o energii równej lub większej niż energia aktywacji dana jest rozkładem statystycznym Maxwella-Boltzmanna:
(3.1)
![]()
gdzie:
N* jest ilością cząsteczek o energii większej niż energia aktywacji E*,
N0 całkowitą ilością cząsteczek,
k stałą Boltzmanna (II.2.1.1.3),
T temperaturą w skali bezwzględnej (Kelwina) (II.2.1.2.3).
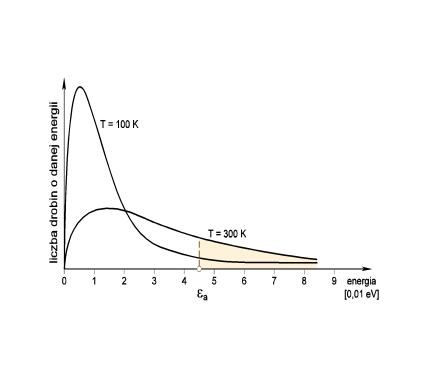
Rys. 3.1 ilustruje rozkład prawdopodobieństwa występowania cząstek o różnej energii E. Obszar zacieniony odpowiada ilości cząsteczek o energii równej lub większej niż energia aktywacji E* dla dwóch temperatur 100K i 300K.
Szybkość reakcji chemicznej jest proporcjonalna do ilości zderzeń aktywnych, a więc do ilości cząsteczek o energii równej lub większej od energii aktywacji E*:
(3.2)
![]()
Jeśli ilość cząsteczek reagujących wyrazimy poprzez ilość moli n to szybkość reakcji można opisać równaniem:
(3.3)
![]()
gdzie:
![]() jest ilością moli,
jest ilością moli,
n* jest ilością moli cząsteczek o energii większej niż energia aktywacji E*,
n0 całkowitą ilością moli danej substancji w układzie,
R = k·NA jest stałą gazową.
Jeśli w układzie mamy ogólną reakcję:
![]()
to szybkość reakcji będzie proporcjonalna do iloczynu stężeń wszystkich cząsteczek biorących udział w reakcji:
gdzie:
![]()
n1, n2,
n3, ......ni
moli reagujących cząsteczek A1,A2,A3,....Ai
składa się na całkowitą
ilość moli n0 (
![]() ), a wartość
), a wartość
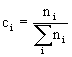 jest stężeniem
substancji Ai.
jest stężeniem
substancji Ai.
Wartości
![]() są współczynnikami
stechiometrycznymi.
są współczynnikami
stechiometrycznymi.
Równanie (3.4a) nosi nazwę równania kinetycznego reakcji chemicznej:
gdzie wartość k jest stałą szybkości reakcji:
Równanie kinetyczne podaje wpływ stężenia reagentów na szybkość reakcji chemicznej.