1.6 Wpływ stężenia reagentów (substratów) na szybkość reakcji chemicznej
Szybkość reakcji jest proporcjonalna do iloczynu stężeń substancji reagujących (substratów) co ilustruje równanie kinetyczne (równanie 3.4a) W równaniu tym stężenia substratów podniesione są do potęgi odpowiadającej wartościom współczynników stechiometrycznych.
Sumę współczynników
stechiometrycznych substancji reagujących (substratów)
![]() nazywamy rzędem reakcji. Rząd reakcji określa jej cząstęczkowość –
ilość cząsteczek reagentów uczestniczących w reakcji.
nazywamy rzędem reakcji. Rząd reakcji określa jej cząstęczkowość –
ilość cząsteczek reagentów uczestniczących w reakcji.
Reakcje pierwszego rzędu
Dla reakcji jednocząsteczkowej mamy:
(6.01)
![]()
(6.02)
![]()
Suma
współczynników stechiometrycznych w
wynosi:
![]() ,
,
![]() (jest podniesione do
pierwszej potęgi).
(jest podniesione do
pierwszej potęgi).
Przykład reakcji pierwszego rzędu:
Rozpad tlenku azotu (V):
(6.03)
![]()
(6.04)
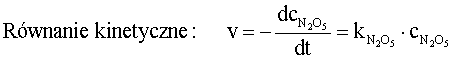
Zmianę stężenia w
czasie dla reakcji (6.03) można opisać zależnościami:
Jeśli oznaczymy:
![]()
możemy równanie (6.04) zapisać w formie:
(6.05)
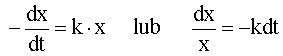
Całkowanie równania (6.05) dla warunków brzegowych:
![]()
daje wyrażenie:
(6.06)
![]()
Z zależności (6.06) można wyznaczyć stałą szybkości reakcji (rys.6.1).
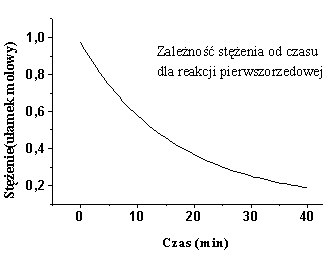
|
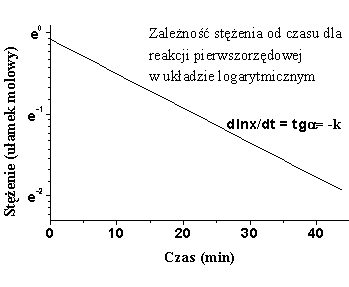 |
| Rys.6.1a | Rys.6.1b |
Rozpad promieniotwórczy jako reakcja pierwszego rzędu
Rozpad izotopu
![]() można opisać reakcją:
można opisać reakcją:
(6.07)
![]()
oraz równaniem kinetycznym:
(6.08)
![]()
gdzie:
N
- liczba atomów
![]() ,
,
![]() -
stała rozpadu
-
stała rozpadu
![]()
Dla warunków brzegowych:
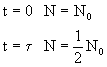
mamy:
(6.09)
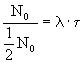
(6.10)
![]()
Wielkość
![]() nosi nazwę czasu połowicznego rozpadu i odpowiada czasowi t po którym
ilość atomów N0 zmniejszy się o połowę:
nosi nazwę czasu połowicznego rozpadu i odpowiada czasowi t po którym
ilość atomów N0 zmniejszy się o połowę:
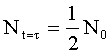
Reakcje drugiego rzędu
Dla reakcji dwucząsteczkowej:
(6.11)
![]()
równanie kinetyczne możemy zapisać w postaci:
(6.12)
![]()
Rząd reakcji będzie wynosił:
![]()
Przykład reakcji drugorzędowej
Reakcja
dimeryzacji
![]() jest przykładem reakcji drugiego rzędu:
jest przykładem reakcji drugiego rzędu:
(6.13)
![]()
(6.14)
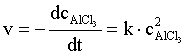
Jeśli przyjmiemy że:
![]()
to równanie kinetyczne (6.14) możemy zapisać w postaci:
(6.15)
![]()
Dla warunków brzegowych:
![]()
mamy po scałkowaniu:
(6.16)
![]()
gdzie x0 jest stężeniem początkowym w chwili t = 0.
Wykres
zależności stężenia od czasu dla reakcji drugiego rzędu przedstawiono
rys.6.2a (dla funkcji
![]() ) oraz 6.2b (dla funkcji
) oraz 6.2b (dla funkcji
![]() ).
).
Z ostatniej zależności (6.16) można wyznaczyć graficznie stałą szybkości reakcji k.
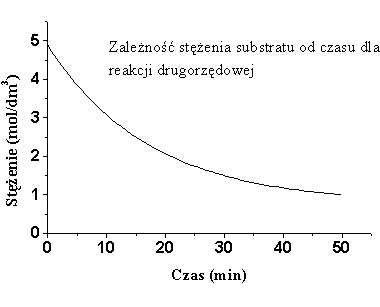 |
| Rys.6.2a |
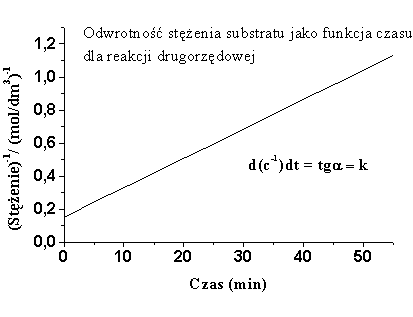
|
| Rys.6.2b |