1.8 Reakcje wieloetapowe
Szybkość procesu chemicznego będącego wynikiem wielu reakcji elementarnych zależy od ich wzajemnej sekwencji – uszeregowania poszczególnych reakcji w czasie. Reakcje chemiczne możemy podzielić na reakcje następcze (konsekutywne) oraz równoległe.
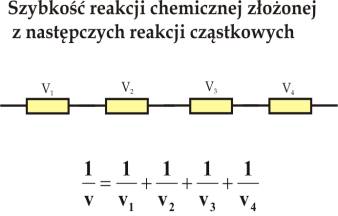
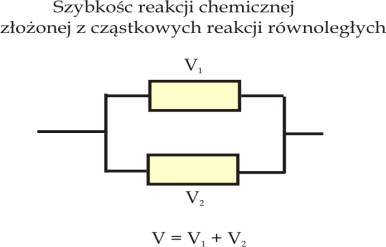
Możemy proces chemiczny składający się z szeregu reakcji cząstkowych porównać do układu elektrycznego składającego się z oporów przez które płyną cząstkowe prądy elektryczne i zastosować do tych obwodów prawo Kirchhoffa (rys.8.1a i b).
Rys.8.1a
Rys.8.1b
Proces chemiczny składający się z reakcji następczych
Dla procesu składającego się z reakcji następczych słuszna jest zależność:
(8.1)
![]()
gdzie v jest szybkością całkowitą procesu chemicznego a v1, v2 .....vi są cząstkowymi reakcjami następczymi. Dla dwóch reakcji cząstkowych mamy:
(8.2)
![]()
oraz po przekształceniu:
(8.3)
![]()
Nietrudno
zauważyć, że jeśli szybkość jednej reakcji cząstkowej jest dużo większa
niż szybkość drugiej reakcji:
![]() to w mianownik dąży do wartości
v1, a równanie (8.3) dąży do wartości v2.
Tak więc dla procesu chemicznego składającego się z reakcji następczych
całkowita szybkość reakcji limitowana jest szybkością reakcji
najwolniejszej, w tym wypadku szybkością v2.
to w mianownik dąży do wartości
v1, a równanie (8.3) dąży do wartości v2.
Tak więc dla procesu chemicznego składającego się z reakcji następczych
całkowita szybkość reakcji limitowana jest szybkością reakcji
najwolniejszej, w tym wypadku szybkością v2.
Proces chemiczny składający się z reakcji równoległych
W przypadku reakcji równoległych całkowita szybkość procesu chemicznego jest sumą szybkości reakcji cząstkowych:
(8.4)
![]()
Dla reakcji chemicznej będącej wynikiem dwóch równoległych reakcji cząstkowych, z których jedna jest o wiele szybsza od drugiej całkowita szybkość reakcji będzie limitowana szybkością szybkiej reakcji cząstkowej:
(8.5)
![]()