1.9 Teoria kompleksu aktywnego (stanu przejściowego)
Teoria stanu przejściowego Eyringa Evansa (1935):
- jest pewnym uzupełnieniem teorii zderzeń
- zajmuje się przebiegiem aktu elementarnego
- precyzyjniej wyjaśnia istotę energii aktywacji.
Podstawowy postulat teorii kompleksu aktywnego brzmi: - zderzenie cząsteczek (drobin) może doprowadzić do utworzenia nietrwałego przejściowego układu tzn. kompleksu aktywnego. Każde zderzenie chemicznie efektywne przebiega przez stadium pośrednie o bardzo krótkim czasie życia ~10-13 s, np. w reakcji atomu A z cząsteczką BC o równaniu stechiometrycznym:
(9.01)
![]()
tworzy
się przejściowo kompleks aktywny
![]() , który może rozpaść się na nowe drobiny substratów A i BC
lub drobiny produktów AB i C. Zmiany, które prowadzą do
powstania produktów zachodzą stopniowo już przy zbliżaniu się A
do BC, nie zaś skokowo w momencie ich maksymalnego zbliżenia. W
miarę zbliżania się A do BC rośnie energia potencjalna
tego trójatomowego układu na skutek pokonywania sił odpychania pomiędzy
A i BC a także osłabienia (przy dostatecznie małych odległościach
obu reagujących cząsteczek) wiązania
, który może rozpaść się na nowe drobiny substratów A i BC
lub drobiny produktów AB i C. Zmiany, które prowadzą do
powstania produktów zachodzą stopniowo już przy zbliżaniu się A
do BC, nie zaś skokowo w momencie ich maksymalnego zbliżenia. W
miarę zbliżania się A do BC rośnie energia potencjalna
tego trójatomowego układu na skutek pokonywania sił odpychania pomiędzy
A i BC a także osłabienia (przy dostatecznie małych odległościach
obu reagujących cząsteczek) wiązania
![]() . Jednocześnie zaczyna się tworzyć wiązanie
. Jednocześnie zaczyna się tworzyć wiązanie
![]() . Jeżeli początkowa energia kinetyczna zbliżających się drobin jest
dostatecznie duża, aby pokonać siły odpychania, może zostać osiągnięta
konfiguracja w której odległości
. Jeżeli początkowa energia kinetyczna zbliżających się drobin jest
dostatecznie duża, aby pokonać siły odpychania, może zostać osiągnięta
konfiguracja w której odległości
![]() i
i
![]() są porównywalne a energia
potencjalna całego układu maksymalna. W tym stanie przejściowym nie można
A i BC traktować jako oddzielnych indywiduów chemicznych.
Wszystkie trzy atomy tworzą wówczas produkt przejściowy quasi - cząsteczkę
nazywaną kompleksem aktywnym.
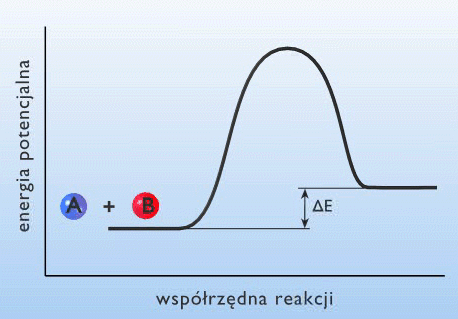
Jakościowo obraz drogi reakcji od tzw. współrzędnej zmiany energii układu
czyli odległości przebytej wzdłuż drogi reakcji przedstawia
Rys.9.1.(Przebieg reakcji z wytworzeniem kompleksu aktywnego).
są porównywalne a energia
potencjalna całego układu maksymalna. W tym stanie przejściowym nie można
A i BC traktować jako oddzielnych indywiduów chemicznych.
Wszystkie trzy atomy tworzą wówczas produkt przejściowy quasi - cząsteczkę
nazywaną kompleksem aktywnym.
Jakościowo obraz drogi reakcji od tzw. współrzędnej zmiany energii układu
czyli odległości przebytej wzdłuż drogi reakcji przedstawia
Rys.9.1.(Przebieg reakcji z wytworzeniem kompleksu aktywnego).
Kliknij na rysunek aby zobaczyć animacje.
Energia aktywacji EA jest równa wysokości bariery energetycznej, którą muszą pokonać reagujące cząstki na drodze reakcji, E`A – energia aktywacji reakcji odwrotnej. Różnica pomiędzy stanem energetycznym produktów i substratów DU jest równa ciepłu reakcji Q.
Koncepcja kompleksu aktywnego pozwala precyzyjniej zdefiniować energię aktywacji jak również cząsteczkowość reakcji. Cząsteczkowość (molekularność) równa jest liczbie cząstek które w danej reakcji elementarnej tworzą kompleks aktywny.
Wysokość bariery energii będącej różnicą pomiędzy energią kompleksu aktywnego a energią substratów jest miarą energii aktywacji danej reakcji chemicznej.
Przykłady energii aktywacji wybranych reakcji chemicznych ujęto w tablicy 9.1a,b,c.
Tablica
9.1a
Reakcje
pierwszego rzędu:
|
Energia aktywacji EA , kJ/mol |
|
|
58 |
|
|
103 |
|
|
154 |
|
|
222 |
|
|
230 |
Tablica
9.1b
|
Reakcje drugiego rzędu |
Energia aktywacji EA , kJ/mol |
|
|
11 |
|
|
38 |
|
|
100 |
|
|
100 |
|
|
134 |
|
|
174 |
|
|
191 |
|
|
335 |
Tablica
9.1c
|
Reakcje heterogeniczne z udziałem katalizatora |
Energia aktywacji EA , kJ/mol |
|
|
105 na Pt, 59 na Au |
|
|
136 na Pt, 121 na Au |
|
|
97 na Sb |