1.10 Kataliza
Zwiększenie szybkości reakcji można osiągnąć przez:
- zwiększenie stężeń reagentów
- zwiększenie stałej szybkości k (poprzez zwiększenie temperatury)
Możliwość zwiększenia stężeń i ciśnienia - jest w praktyce ograniczona np. rozpuszczalnością reagentów, wytrzymałością aparatury.
Podwyższenie temperatury zwiększa szybkość reakcji, ale w reakcjach egzotermicznych obniża wydajność.
Już w XIX wieku zauważono, że pewne substancje obecne w układzie reagującym mogą wpływać na przebieg reakcji choć same w wyniku jej nie ulegają przemianom chemicznym. Reakcje zachodzące pod wpływem takich substancji nazywano reakcjami katalitycznymi.
Katalizatorem danej reakcji nazywamy substancję, która wprowadzona do układu reagującego zwiększa szybkość tej reakcji a sama nie ulega przemianom chemicznym w ostatecznym wyniku reakcji.
Przyśpieszenie reakcji przez katalizator polega na zmniejszeniu energii aktywacji w porównaniu z reakcją nie katalityczną. Dla reakcji zachodzącej bez katalizatora:
(10.01)
![]()
mamy energię aktywacji EA. Tą samą reakcję przebiegającą przy udziale katalizatora K można opisać równaniami:
(10.02)
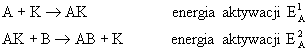
Jeżeli reakcja bez katalizatora wymaga energii aktywacji EA to w obecności katalizatora K, dwie reakcje wykazują energię aktywacji E1 i E2 przy czym każda z nich jest mniejsza od EA (rys.10.1).
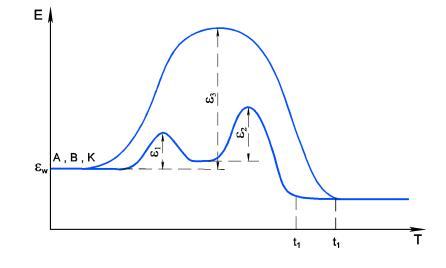
Rys.10.1 Wpływ katalizatora na szybkość reakcji.
Wzrost szybkości reakcji wynika z niższej energii aktywacji kolejnych etapów w porównaniu z energią aktywacji jednoetapowej przemiany bez katalizatora.
Kataliza homogeniczna
Katalizator może
stanowić jeden ze składników jednorodnej fazy (gazowej lub ciekłej) w której
zachodzi reakcja - mówimy wówczas o katalizie homogenicznej, jednorodnej,
jednofazowej.
Przykładem
reakcji katalitycznej jednofazowej może być utlenianie
![]() do
do
![]() w komorowej metodzie produkcji
kwasu siarkowego:
w komorowej metodzie produkcji
kwasu siarkowego:
(10.03)
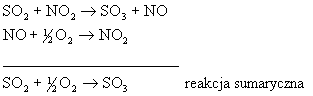
Wszystkie
składniki reakcji –substraty (
![]() ,
,
![]() ), katalizator (
), katalizator (
![]() ) oraz produkt
) oraz produkt
![]() są substancjami gazowymi i tworzą układ jednofazowy.
są substancjami gazowymi i tworzą układ jednofazowy.
Kataliza
heterogeniczna
Jeśli
katalizator stanowi odrębną fazę w układzie reagującym to katalizowana
reakcja przebiega na granicy faz i wówczas mamy do czynienia z katalizą
niejednorodną (heterogeniczną, wielofazową).
Najczęściej katalizator jest wtedy ciałem stałym, reakcja zaś przebiega
pomiędzy substancjami gazowymi. Np. katalityczne syntezy
![]() prowadzone są przeważnie z
udziałem katalizatora stałego (metalu lub tlenku metalu). W tablica 10.1
ujęto przykłady reakcji katalitycznych w układzie heterogenicznym.
prowadzone są przeważnie z
udziałem katalizatora stałego (metalu lub tlenku metalu). W tablica 10.1
ujęto przykłady reakcji katalitycznych w układzie heterogenicznym.
Tablica 10.1
|
Reakcja |
Katalizator |
Energia aktywacji kJ/mol |
|
|
brak |
335 |
|
wolfram |
163 |
|
|
osm |
197 |
|
|
|
brak |
184 |
|
platyna |
105 |
|
|
złoto |
59 |
|
|
|
brak |
247 |
|
platyna |
138 |
|
|
złoto |
121 |
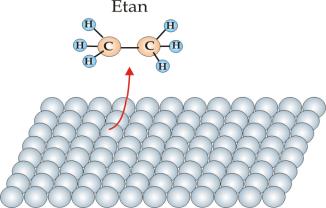
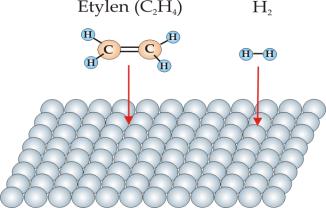
Na rys.10.2 przedstawiono mechanizm katalitycznego uwodorniania etylenu C2H2 zgodnie z reakcją:
(10.04)
![]()
Reakcja przebiega na powierzchni katalizatora w czterech etapach. Pierwszy etap to adsorpcja etylenu i wodoru na powierzchni katalizatora (rys.10.2a). W wyniku oddziaływania z katalizatorem cząsteczka wodoru ulega katalitycznej dysocjacji, której wynikiem jest powstanie dwóch zaadsorbowanych atomów wodoru (rys.10.2b). Następnie atomy wodoru są kolejno podstawiane do grup metylenowych (rys.10.2b i 10.2c) przekształcając je w grupy metylowe. W końcowym stadium nowo powstała cząsteczka etanu ulega desorpcji z powierzchni katalizatora (rys.10.2d).
Rys.10.2a
Rys.10.2b
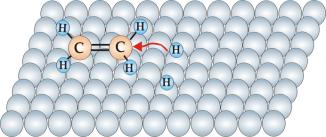
Rys.
10.2c
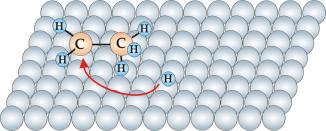
Rys.
10.2d