2. Statyka chemiczna
2.1 Stan równowagi chemicznej
Wszystkie reakcje chemiczne są procesami odwracalnymi (odwracalność chemiczna reakcji polega na możliwości przeprowadzenia jej w obu kierunkach). Dopiero w specjalnych warunkach reakcje mogą przebiegać nieodwracalnie np. gdy jeden z produktów opuszcza środowisko reakcji, reakcja wtedy biegnie aż do wyczerpania substratów.
Np. reakcja cynku z kwasem siarkowym:
(1.01)
![]()
prowadzona
w otwartym naczyniu, z którego wodór może się wydzielać swobodnie,
przebiega aż do wyczerpania Zn lub
![]() . Można jednak spowodować jej przebieg w odwrotnym kierunku:
. Można jednak spowodować jej przebieg w odwrotnym kierunku:
(1.02)
![]()
wprowadzając
wodór pod wysokim ciśnieniem do wodnego roztworu
![]() .
.
Ze
zjawiskiem odwracalności reakcji wiąże się względny charakter terminów
“substraty”, “produkty”. W
celu uniknięcia dwuznaczności przyjmuje się, że substraty to substancje
zapisane po lewej, a produkty po prawej stronie równania chemicznego.
Jak można zauważyć kierunek reakcji zależy od warunków. Teoretycznie każda reakcja w odpowiednich warunkach przebiega w obu kierunkach.
Jeżeli szybkość reakcji w prawo zdecydowanie dominuje nad szybkością reakcji w lewo, to substraty niemal ilościowo przereagowują w produkty a proces uważa się za praktycznie nieodwracalny, czyli biegnący do końca (rys.1.1a i b).
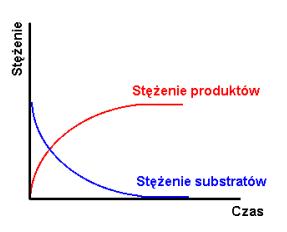
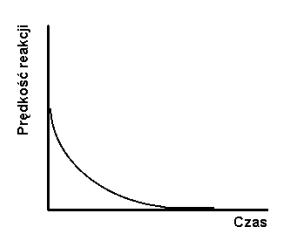
Rys.1.1. Stężenie substratów i produktów (a) oraz szybkość reakcji (b) jako funkcja czasu dla reakcji nieodwracalnej.
Gdy
szybkości reakcji w obu kierunkach są takie same wówczas wytwarza się
stan równowagi chemicznej (równoznaczny ze stanem równowagi
termodynamicznej). W
stanie równowagi chemicznej ilość substratów i produktów nie ulega
zmianie choć obie reakcje zachodzą w dalszym ciągu (rys.1.2 a i b).
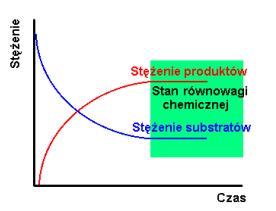
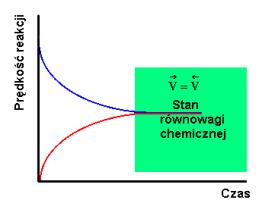
Rys.1.2. Stężenie substratów i produktów (a) oraz szybkość reakcji (b) jako funkcja czasu dla reakcji odwracalnej prowadzącej do równowagi chemicznej.
Stan równowagi chemicznej wytwarza się w układach zamkniętych (nie wymieniających masy z otoczeniem).
Dla określenia, że dana
reakcja osiąga w danych warunkach stan równowagi stosuje się w równaniach
chemicznych znak strzałki w obu kierunkach
![]() zwany znakiem równowagi, np.:
zwany znakiem równowagi, np.:
(1.03)
![]()
Jedną strzałkę stosuje się gdy:
- układ nie osiąga stanu równowagi np. podczas rozpuszczania metalu (cynku) w kwasie siarkowym w naczyniu otwartym
- przy teoretycznym założeniu 100 % wydajności (np. prze obliczaniu efektów cieplnych) ciepła reakcji.
- jeżeli proces rozpatruje się w jednym kierunku w celu podania równania kinetycznego na szybkość reakcji w jedną stronę.