2.2 Prawo działania mas – prawo równowagi chemicznej (Guldberga i Waagego)
Stan równowagi chemicznej w reakcjach odwracalnych ma charakter dynamiczny. Oznacza to, że mimo iż stężenie produktów i substratów jest stałe w czasie procesy chemiczne przebiegają w obu kierunkach (tworzenia i rozpadu) z jednakową szybkością (rys.1.2). Dla reakcji o równaniu stechiometrycznym:
(2.01)
![]()
gdzie:
![]() - współczynnik
stechiometryczny substratu Ai,
- współczynnik
stechiometryczny substratu Ai,
![]() - współczynnik stechiometryczny produktu Bi,
- współczynnik stechiometryczny produktu Bi,
możemy napisać odpowiednie równania kinetyczne (IV.1.3) przypisane reakcjom w obu kierunkach:
(2.02a)
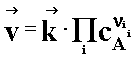
(2.02b)
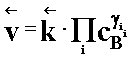
Warunek równowagi można zapisać następująco:
(2.03)

Po podstawieniu równań kinetycznych (2.02a i b)do równania (2.03) otrzymujemy zależność:
(2.04)
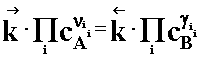
Grupując stałe szybkości reakcji k po jednej stronie mamy:
(2.05)
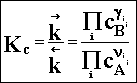
Wielkość
„Kc” będąca ilorazem stałych szybkości reakcji wyznaczających
równowagę nosi nazwę stałej równowagi chemicznej.
Kc
- oznacza stężeniową stałą równowagi chemicznej (zwaną w skrócie stałą
równowagi) - wielkość charakterystyczną dla danej reakcji w danej
temperaturze.
Zależność
powyższa znana jest pod nazwą prawa działania mas (Guldberga i Waagego),
lub prawa równowagi chemicznej, które mówi, że:
w stanie równowagi
chemicznej stosunek iloczynu stężeń produktów reakcji (w potęgach ich
współczynników stechiometrycznych) do iloczynu stężeń substratów (w
potęgach ich współczynników stechiometrycznych) jest w danych warunkach
ciśnienia i temperatury wielkością stałą i charakterystyczną dla danej
reakcji.
Równanie Guldberga Waagego można przedstawić w formie ogólnej:
(2.06)
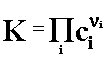
gdzie:
![]() - współczynniki stechiometryczne, dodatnie dla produktów, ujemne dla
substratów.
- współczynniki stechiometryczne, dodatnie dla produktów, ujemne dla
substratów.
Przy stosowaniu prawa działania mas w obliczeniach chemicznych należy pamiętać, że:
Wartość stałej równowagi zależy od “kierunku” zapisu równania chemicznego i temperatury, np:
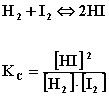
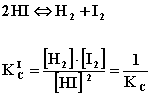
Dlatego wartości stałej równowagi podaje się zawsze z równaniem i temperaturą.
Obok stałej równowagi wyrażonej za pomocą stężeń molowych, stosuje się jeszcze stałe równowagi wyrażone za pomocą ułamków molowych i ciśnień parcjalnych w przypadku układów gazowych.
Stała równowagi wyrażona w ułamkach molowych
Stężenia molowe ci i ułamek molowy xi reagenta wynoszą odpowiednio:
(2.07)
![]()
(2.08)
![]()
gdzie: n – całkowita ilość moli,
ni – ilość moli reagenta,
V – objętość w dm3.
Wykorzystując definicje stężenia molowego (2.07) i ułamka molowego (2.08) możemy przedstawić relacje pomiędzy stałą równowagi Kc wyrażoną przy pomocy stężeń molowych, a stałą Kx wyrażoną przy pomocy ułamków molowych:
![]()
![]()
(2.09)
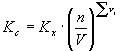
![]()
gdzie:
![]() - różnica ilości moli produktów i substratów
- różnica ilości moli produktów i substratów
ni – współczynniki stechiometryczne
Kx – stała równowagi wyrażona za pomocą ułamków molowych
Kc – stała wyrażona za pomocą stężeń.
Stała równowagi wyrażona w ciśnieniach cząstkowych
W przypadku reakcji w układach gazowych zamiast stężeń molowych posługujemy się ciśnieniami cząstkowymi reagentów. Z równania stanu gazu doskonałego (II.2.1.2.5) wynika zależność pomiędzy ciśnieniem cząstkowym (parcjalnym) a jego stężeniem:
![]()
![]()
![]()
Z przedstawionych wyżej zależności wynika relacja pomiędzy stałą równowagi Kc wyrażoną przy pomocy stężeń molowych, a stałą Kp wyrażoną poprzez ciśnienia cząstkowe:
(2.10)
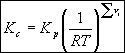
(2.11)
![]()
Korzystając z prawa Dalton (II.2.1.2.6) możemy uzyskać relację Kp i Kx :
![]() ;
;
![]()
(2.12)
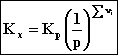
(2.12)
![]()
gdzie: pi - ciśnienie parcjalne i-tego składnika
ni - liczba moli i - tego składnika w danej objętości
p – ciśnienie całkowite.
![]()
Przykład:
Dla reakcji syntezy amoniaku ustala się równowaga:
![]()
Stała równowagi wyrażona za pomocą stężeń:
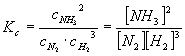
Nawiasy kwadratowe oznaczają stężenia molowe poszczególnych reagentów.
Stała równowagi wyrażona przy pomocy ciśnień parcjalnych:
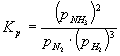 ;
;![]()
![]()
![]()
Stała równowagi wyrażona przy pomocy ułamków molowych:
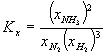
![]()
![]()