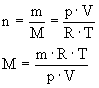2.1.2.5 Równanie stanu dla gazu doskonałego
Równania Boyle,a – Mariotte’a i Gay Lussaca można sprowadzić do ogólnego równania wiążącego parametry wyznaczające stan gazu doskonałego. Parametrami tymi są ciśnienie p, objętość v, temperatura T, oraz ilość moli gazu n i nazywamy je parametrami stanu. Równanie wiążące parametry stanu nosi nazwę równania stanu.
Równanie stanu dla gazu doskonałego ma postać:
Stałą c jest proporcjonalna do masy gazu. Obliczmy tą stałą dla jednego mola gazu pozostającego w warunkach normalnych. Otrzymamy wówczas stałą uniwersalną R noszącą nazwę stałej gazowej:
Warunki normale:
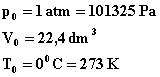
![]()
Dla
jednego mola gazu równanie stanu można zapisać w postaci:
Dla
n moli gazu równanie stanu gazu doskonałego przyjmuje formę ogólną:
Równanie
(2.27)
![]()
Równanie stanu gazu doskonałego stosujemy do obliczania ciśnienia, objętości, gęstości dla znanej ilości gazu w różnych temperaturach, a także do oznaczania masy molowej substancji w stanie pary.
Masę molową (V.1.3.1) wyznaczamy z zależności:
Gdzie M jest masą molową substancji której pary o masie m wypełniają naczynie o pojemności V.
Gęstość gazu można uzyskać ze wzoru:
Przykład 1

Temat: Do produkcji polimeru PCV używany jest chloroeten. 3,93 mole tego gazu zajmują objętość 98,4 dm3 w temperaturze 24oC. Jakie jest ciśnienie tego gazu ?
Rozwiązanie : Wykorzystujemy równanie gazu doskonałego , które mówi że :
Nasze
dane:
v
= 98,4 dm3= 98,4 . 10-3m3
n
= 3,93 mole
T
= (24 + 273)K = 297K
R
= 8,31 Pa m3K-1mol-1
Po
podstawieniu do wzoru mamy:
![]()
Odpowiedź: Ciśnienie gazu wynosi 9,86 . 104 Pa.
Przykład 2

Temat: Jaką objętość zajmuje jeden mol gazu doskonałego w temperaturze 20oC i pod ciśnieniem 105Pa ?
Rozwiązanie:
Posłużymy
się równaniem stanu gazu doskonałego
Nasze
dane:
n
= 1,00 mol
T
= (20 + 273)K=293K
p
= 105 Pa
R
= 8,31 Pa m3K-1mol-1
Po
podstawieniu mamy:
![]()
Odpowiedź: Jeden mol gazu w podanych warunkach zajmie objętość 24 dm3.