2.1.2.4 Prawo Charlesa. Przemiana izochoryczna.
W
stałej objętości ciśnienie danej masy gazu jest wprost proporcjonalne do
temperatury:
![]() oznacza ciśnienie
danej masy gazu w temperaturze 00C, a
oznacza ciśnienie
danej masy gazu w temperaturze 00C, a
![]() jest współczynnikiem
rozszerzalności równym
jest współczynnikiem
rozszerzalności równym
![]() .
.
Po wprowadzeniu do równania (2.22) temperatury bezwzględnej (II.2.1.2.3) otrzymamy zależność:
Rys.2.07 ilustruje graficzny przebieg izochory.
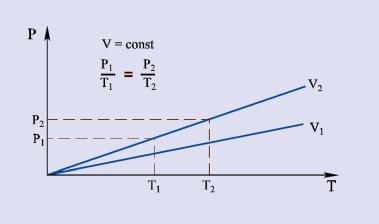
Rys. 2.07. Wykres izochory gazu doskonałego.
Przykład 1

Temat: W naczyniu zamkniętym znajduje się tlen pod ciśnieniem 850 hPa i w temperaturze273 K. Jakie będzie ciśnienie tego gazu w temperaturze 300 K ?
Rozwiązanie :
Nasze
dane:
p1=850
hPa
p2=
?
T1=273
K
T2=300
K
Ponieważ
przemiana jest izochoryczna (v = const) zastosujemy prawo Charles’a
Po podstawieniu
![]()
Odpowiedź: Ciśnienie gazu wzrośnie do 934,06 hPa.
Przykład 2

Temat: Do jakiej temperatury należy ogrzać 5 cm3 gazu o temperaturze 290 K aby jego objętość wzrosła do 10 cm3 (przy zachowaniu stałego ciśnienia) ?
Rozwiązanie:
Nasze
dane:
v1=
5 cm3
T1
= 290 K
v2=
10 cm3
T2=
?
Przemiana jest izobaryczna a więc stosujemy prawo Gay Lussaca
Po podstawieniu mamy:
Odpowiedź: Gaz należy podgrzać do temperatury 580 K.