2.3 Równowaga w układach heterogenicznych
Równowaga C, CO, CO2
Bardzo często reakcje równowagowe ustalają się pomiędzy reagentami występującymi w różnych fazach. Przykładem takiej reakcji może być reakcja zachodząca pomiędzy CO2 a stałym węglem, zachodząca w wysokich temperaturach:
(3.01)
![]()
symbol (s) – oznacza, że badana substancja występuje w stanie stałym; (g) – gazowym.
Dla stanu równowagi, prawo działania mas można wyrazić za pomocą ułamków molowych:
(3.02)
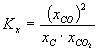
Tlenki węgla tworzą wspólną fazę gazową, skład jej podają ułamki molowe (lub stężenia molowe, lub ciśnienia parcjalne).
Węgiel tworzy osobną
fazę, występuje w stanie stałym, jako substancja, stąd
![]() . Przyjęcie równości
. Przyjęcie równości
![]() oznacza, że w skład fazy stałej nie ulega zmianie w czasie reakcji
chemicznej i rzeczywiście tak jest. W przeciwieństwie do fazy gazowej której
skład ulega zmianie w czasie reakcji faza stała zachowuje swój skład a
zmianie ulega jedynie jej masa.
oznacza, że w skład fazy stałej nie ulega zmianie w czasie reakcji
chemicznej i rzeczywiście tak jest. W przeciwieństwie do fazy gazowej której
skład ulega zmianie w czasie reakcji faza stała zachowuje swój skład a
zmianie ulega jedynie jej masa.
Prawo działania mas możemy teraz zapisać w uproszczonej postaci:
(3.03)
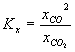
Prawo działania mas dla rozpatrywanej równowagi heterogenicznej można również zapisać za pomocą ciśnień cząstkowych reagentów występujących w fazie gazowej. Wystarczy podstawić za ułamki molowe następujące wyrażenia:
![]() ;
;
![]()
![]() – ciśnienie parcjalne CO
– ciśnienie parcjalne CO
![]() - ciśnienie parcjalne CO2
- ciśnienie parcjalne CO2
![]() - ciśnienie całkowite
- ciśnienie całkowite
(3.04)
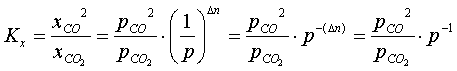
gdzie:
![]() ;
;
![]() liczymy tylko dla reagentów
występujących w fazie gazowej.
liczymy tylko dla reagentów
występujących w fazie gazowej.
Równowaga
CaCO3, CaO, CO2
Jako kolejny przykład równowagi chemicznej w układzie heterogenicznym można rozważyć termiczny rozkład stałego węglanu wapnia:
(3.05)
![]()
Uwzględniając fakt, że w układzie pojawia się tylko jedna faza gazowa CO2, równanie wyrażające prawo działania mas przyjmuje postać:
(3.06)
![]() ;
;
![]() ;
;
jeżeli: p = 1 atm;
(3.07)
![]()