2.4 Reguła Le Chateliera i Browna (Reguła przekory)
Zmiana parametrów wyznaczających stan równowagi chemicznej – stężenia reagentów, temperatury i ciśnienia prowadzą do zaburzenia (przesunięcia) równowagi. Układ chemiczny dąży wtedy do nowego stanu równowagi wyznaczonego „nowymi”, zmienionymi parametrami. Wpływ zmiany stężenia reagentów, ich ciśnienia oraz temperatury na stan równowagi określa reguła Le Chateliera i Browna (reguła przekory).
Reguła
ta mówi, że jeżeli zostanie zakłócony stan równowagi przez zmiany T,
p, c, w układzie rozpoczyna się taka przemiana, która będzie
przeciwdziałała zakłóceniom prowadząc do osiągnięcia ponownego
stanu równowagi.
Przemiany zainicjowane zakłóceniem równowagi trwają aż do ponownego zrównoważenia się szybkości reakcji przebiegających w przeciwnych kierunkach. Po pewnym czasie równowaga znów się ustala, ale już przy innych niż poprzednio stężeniach.
Reasumując reguła przekory brzmi:
Jeżeli układ będący w stanie równowagi poddamy działaniu zewnętrznemu, tj. zmianie stężenia reagentów, zmianie ciśnienia lub zmianie temperatury, to w układzie tym przesuwa się równowaga chemiczna w kierunku kompensacji tych zmian.
Wpływ zmiany stężenia na stan równowagi
Weźmy dla przykładu reakcję:
(4.01)
![]()
przebiegającą
w 2400 °C
w której stała równowagi wynosi:
![]() . Pytamy się jak zmieni się wydajność procesu - w którą stronę
przesunie się równowaga jeżeli oba gazowe substraty zamiast w stosunku
stężeniowym 1 : 1 zamieszamy w stosunku 4 : 1 (czterokrotnie
zwiększymy stężenie N2).
. Pytamy się jak zmieni się wydajność procesu - w którą stronę
przesunie się równowaga jeżeli oba gazowe substraty zamiast w stosunku
stężeniowym 1 : 1 zamieszamy w stosunku 4 : 1 (czterokrotnie
zwiększymy stężenie N2).
Rozwiązanie:
Przypadek I: substraty zmieszane w stosunku 1:1
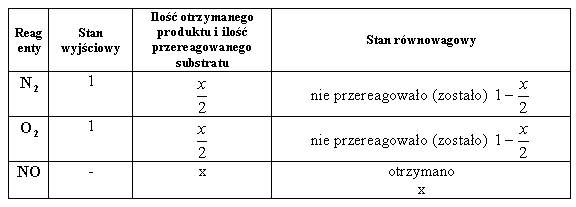
Podstawiając równowagowe wartości stężeń do równania na stałą równowagi otrzymujemy:
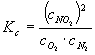
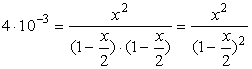
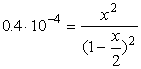
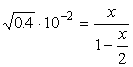
![]()
![]()
![]()
Przypadek II: zmieszano substraty w stosunku 4:1
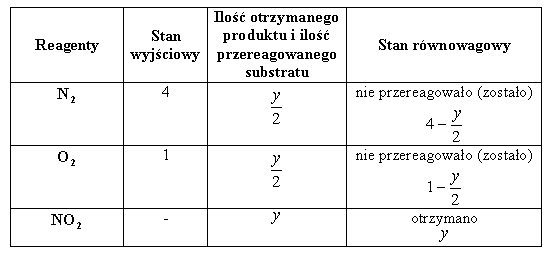
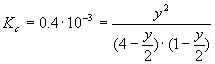
![]()
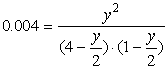
![]()
![]() 1/2×4
1/2×4
![]()
![]()
![]()
-
Ze wzrostem stężeń substratów wydajność wzrosła:
w pierwszym przypadku otrzymano
0.03 mola
w drugim przypadku otrzymano 0.05
mola
-
Równowaga przesunęła się z lewo na prawo w kierunku syntezy NO
-
Stała Kc pozostaje bez zmiany, ma tę samą wartość gdyż
reakcja przebiega w stałej temperaturze.
Wzrost
stężenia substratów, w układzie powoduje przesunięcie równowagi z lewa
na prawo w kierunku syntezy produktu, tym samym zwiększa wydajność
procesu.
Wpływ
zmian ciśnienia na stan równowagi
Zmiana
ciśnienia wywiera wpływ na wydajność reakcji jedynie wtedy, gdy liczba
moli produktów reakcji jest różna od liczby substratów Dn
![]() 0, np. w reakcji syntezy
amoniaku:
0, np. w reakcji syntezy
amoniaku:
(4.02)
![]()
z
4 moli substratów powstaje 2 mole produktów, Dn
= - 2. Reakcji przebiegającej z lewa na prawo, towarzyszy
zmniejszenie ilości moli. Wzrost ciśnienia w układzie, w którym
zachodzi reakcja syntezy amoniaku, spowoduje przesunięcie równowagi w
kierunku kompensacji ciśnienia, czyli w kierunku zmniejszenia ilości moli
(tzn. w kierunku syntezy
![]() )
)
W przypadku gdy Dn < 0 wzrost ciśnienia powoduje przesunięcie równowagi w prawo w kierunku w kierunku zmniejszenia ilości moli.
- w przypadku gdy Dn > 0 np. w procesie:
(4.03)
![]()
wzrost
ciśnienia powoduje przesunięcie równowagi w lewo w kierunku tworzenia N2O4
tj. w kierunku zmniejszenia ilości moli.
· - w przypadku gdy Dn = 0, liczba moli produktów = liczbie moli substratów:
(4.04)
![]()
zmiana ciśnienia nie wywołuje żadnych zmian w układzie znajdującym się w stanie równowagi.
Wpływ temperatury na stan równowagi
Zależność stałej równowagi (Kc, Kp, Kx) od temperatury określa równanie:
(4.05)
![]()
(równanie analogiczne do równania Arrheniusa).
gdzie:
A – stała charakterystyczna dla danej reakcji
Q – ciepło reakcji
R – stała gazowa
T – temperatura.
Wzrost temperatury przesuwa położenie równowagi chemicznej, w myśl reguły przekory i równocześnie zmienia wartość stałej równowagi Kc, w odróżnieniu od zmian stężenia, które przesuwają równowagę przy zachowaniu tej samej wartości Kc.
Jeżeli reakcja jest endotermiczna (V.2.1.1) tzn. towarzyszy jej pochłanianie ciepła to wzrost temperatury w myśl reguły przekory przesuwa równowagę w kierunku kompensacji tej zmiany, czyli w kierunku pochłaniania ciepła ( tj. z lewej strony na prawą).
Wzrost temperatury w przypadku reakcji egzotermicznej (V.2.1.1), egzoenergetycznej (takiej której towarzyszy wydzielanie ciepła) przesuwa ją w kierunku odwrotnym (z prawej strony na lewą).
Przykład:
Rozważymy wpływ temperatury na stan równowagi reakcji syntezy amoniaku:
![]()
![]()
indeks (p) oznacza że reakcja biegnie przy stałym ciśnieniu.
Jest to reakcja egzotermiczna (ciepło wydziela się w czasie reakcji).
Wzrost temperatury w myśl reguły przekory przesuwa równowagę w kierunku kompensacji wzrostu temperatury – w kierunku pochłaniania ciepła, czyli z prawej strony na lewą. Oznacza to, że ze wzrostem temperatury wydajność procesu (ilość amoniaku) maleje.