1.3.2 Stechiometria wzorów chemicznych
Atomy tworząc cząsteczki łączą się ze sobą w różnych stosunkach. Mogą powstawać cząsteczki takie jak np.: NaCl, MgCl2, AlCl3, CCl4. Stosunki atomów tworzących cząsteczki zmieniają się w podanych przykładach od 1:1 do 1:4. O tym ile atomów wchodzi w skład cząsteczki i jakie są stosunki atomowe decyduje zdolność atomów do łączenia się ze sobą zwana wartościowością. W podanych wzorach atom chloru jest jednowartościowy. Wartościowość pozostałych składników tworzących związki: sód, magnez, glin, węgiel przyjmuje wartość odpowiednio jeden, dwa, trzy lub cztery. Wartościowość, zatem to liczba określająca zdolność atomu pierwiastka do przyłączania innych jednowartościowych atomów. Wartościowość pierwiastków oznacza się liczbami rzymskimi. Stąd wartościowość fosforu w związku PCl5 wynosi pięć (V), tlenu w wodzie dwa (II), a siarki w heksafluorku siarki SF6 sześć (VI). W oparciu o tak stworzone pojęcie wartościowości można ustalić wartościowość innych pierwiastków np.: chromu w CrO3 jako sześciowartościowego, czy chloru w Cl2O7 jako siedmiowartościowego. Wartościowość pierwiastka jest elementem nazwy związku chemicznego np. azotan(V) żelaza(III), siarczan(VI) tetraaminamiedzi(II), ortofosforan(V) sodu.
Pojęcie wartościowości jest użyteczne przy pisaniu wzorów strukturalnych związków chemicznych. Np.: wzory strukturalne tlenku glinu, kwasu siarkowego(VI) lub etanu C2H6 można przedstawić następująco:
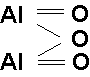
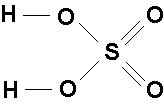
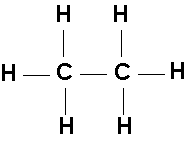
Innym sposobem
wyrażania wartościowości pierwiastków jest stopień
utlenienia. Jest to dodatnia lub ujemna liczba
będąca hipotetycznym ładunkiem atomu, który istniałby, gdyby cząsteczka
w skład, której wchodzi atom zbudowana byłaby z jonów.
Stopień utlenienia umownie przypisuje ładunek atomom bez względu na rodzaj wiązań występujących w cząsteczkach. Przy ustalaniu stopnia utlenienia atomów należy kierować się następującymi regułami:
1. Stopień utlenienia atomu pierwiastka występującego w stanie wolnym równy jest zeru.
2. Stopień utlenienia atomów pierwiastków o różnej elektroujemności ustala się przypisując pierwiastkowi bardziej elektroujemnemu ładunek ujemny, przy czym wartość tego ładunku jest równa ilości elektronów wiążących.
3. Elektrony wiążące dwa te same atomy dzieli się między te atomy
4. Suma stopni utlenienia atomów w cząsteczce jest równa zeru, a w jonie jest równa ładunkowi jonu.
Na podstawie powyższych reguł można ustalić stopnie utlenienia atomów:
1. w pierwiastkach (np.: F2, O2, N2, H2, S8, C, Fe, Na) stopień utlenienia równy jest 0 (patrz reguła 1).
2.
we fluorkach prostych i złożonych fluor występuje na –1 stopniu
utlenienia np.: Na+1F-1,
![]() ,
,
![]() (zgodnie z regułą 2).
(zgodnie z regułą 2).
3.
W większości związków chemicznych tlen występuje na –2 stopniu
utlenienia np.:
![]() (zgodnie z regułą 2). W
nadtlenkach, a więc w związkach, w których występuje dwuwartościowa
grupa
(zgodnie z regułą 2). W
nadtlenkach, a więc w związkach, w których występuje dwuwartościowa
grupa
![]() tlen występuje na –1 stopniu utlenienia np.:
tlen występuje na –1 stopniu utlenienia np.:
![]() (zgodnie z regułą 3).
(zgodnie z regułą 3).
4.
Wodór występuje na ogół na +1 stopniu utlenienia, np.:
![]() , niekiedy w połączeniach z metalami występuje na –1 stopniu utlenienia
np.:
, niekiedy w połączeniach z metalami występuje na –1 stopniu utlenienia
np.:
![]() (zgodnie z regułą 2).
(zgodnie z regułą 2).
5. Często pomocna jest znajomość położenia pierwiastka w układzie okresowym. Warto pamiętać, że pierwiastki pierwszych dwóch grup układu okresowego występują w związkach chemicznych na stopniu utlenienia równym numerowi grupy.
6.
W oparciu o regułę 4 można obliczyć stopień utlenienia
pierwiastka znając stopnie utlenienia pozostałych np.: chromu w
![]() lub manganu w jonie
lub manganu w jonie
![]() . W celu obliczenia stopnia utlenienia chromu należy ułożyć równanie
bilansujące sumę stopni utlenienia pierwiastków wchodzących w skład cząsteczki
i przyrównać je do zera (wypadkowy ładunek cząsteczki = 0). Zatem
otrzymuje się równanie z jedną niewiadomą:
2*(+1) + 2*x + 7*(-2) = 0. Rozwiązanie daje w wyniku stopień
utlenienia chromu równy +6. Podobnie dla manganu bilans stopni utlenienia
wynosi x + 4*(-2) = -1, a rozwiązaniem jest stopień utlenienia manganu równy
+7.
. W celu obliczenia stopnia utlenienia chromu należy ułożyć równanie
bilansujące sumę stopni utlenienia pierwiastków wchodzących w skład cząsteczki
i przyrównać je do zera (wypadkowy ładunek cząsteczki = 0). Zatem
otrzymuje się równanie z jedną niewiadomą:
2*(+1) + 2*x + 7*(-2) = 0. Rozwiązanie daje w wyniku stopień
utlenienia chromu równy +6. Podobnie dla manganu bilans stopni utlenienia
wynosi x + 4*(-2) = -1, a rozwiązaniem jest stopień utlenienia manganu równy
+7.
7. Istnieją związki chemiczne, w których jeden i ten sam pierwiastek występuje na dwóch różnych stopniach utlenienia np. tlenek żelaza(II) i żelaza(III) Fe3O4, tlenek ołowiu(II) i ołowiu(IV) Pb3O4, czy tiosiarczan(VI) sodu Na2S2O3 zawierający siarkę na +6 i –2 stopniu utlenienia. Formalnie obliczony stopień utlenienia jest wartością średnią. Podobnie przedstawia się zagadnienie liczenia stopnia utlenienia węgla w związkach organicznych, w których czterowartościowy atom węgla może mieć różne stopnie utlenienia.
Zapamiętaj!
Stopnie utlenienia oznacza się
liczbami ze znakiem, np.. Fe+2, N-3, S-2,
Cl-1, Zn0, przy czym znak dodatni lub ujemny zapisuje
się przed liczbą. Inaczej oznacza się ładunek jonu np. Fe2+,
S2-, Cl-.
Wzór chemiczny substancji podaje skład jakościowy i ilościowy pierwiastków budujących związek chemiczny. Wzór wodorowęglanu wapnia Ca(HCO3)2 informuje, że w skład tej soli wchodzi wapń, wodór, węgiel i tlen. Ze wzoru wynika także, że na 1 mol związku składają się 1 mol wapnia, 2 mole wodoru, 2 mole węgla i 6 moli tlenu. Pozwala to, w oparciu o masy molowe podane w układzie okresowym, obliczyć masę molową węglanu wapnia:
![]()
Znając masę molową oraz udział poszczególnych pierwiastków można wyliczyć ich skład procentowy. Procentowa zawartości wynoszą:
| wapnia | |
| wodoru | |
| węgla | |
| tlenu |
100,00 - (24,72+1,24 + 14,82) = 59,22 %. |
Sprawdźmy czy jest możliwe odwrócenie tego zagadnienia. To znaczy, czy znając skład ilościowy związku możliwe jest określenie jego wzoru chemicznego.
Przykład 8.
Podaj wzór substancji o masie molowej 46,034 i składzie 52,14 % węgla, 13,13 % wodoru i resztę tlenu.
Rozwiązanie.
Wzór szukanej substancji można przedstawić jako CxHyOz, co oznacza, że w 1 molu związku znajduje się x moli atomów węgla, y moli atomów wodoru i z moli atomów tlenu. Z drugiej strony w 1 molu czyli 46,034 gramach tego związku znajduje się:
| węgla | |
| wodoru | |
| i tlenu | 46,034 – (24,00 + 6,04) = 15,99 g. |
Zatem można zapisać:
w przypadku węgla: x moli * 12, 011 g/mol = 24,00 g
co oznacza, żę x = 2,0
w przypadku wodoru: y moli * 1,008 g/mol = 6,04 g
a stąd y = 6,0
w przypadku tlenu: z moli * 15,999 g/mol = 15,99 g
czyli z = 1,0
Odpowiedź.
Szukany wzór chemiczny to C2H6O.
Zapamiętaj!