2.2 Obliczenia termochemiczne
Obliczenia
termochemiczne dotyczą ustalenia efektów cieplnych reakcji chemicznych.
Efekty cieplne reakcji chemicznych prowadzonych w warunkach stałego ciśnienia
są równe zmianie entalpii układu ![]() H,
a prowadzone w warunkach stałej objętości energii wewnętrznej
H,
a prowadzone w warunkach stałej objętości energii wewnętrznej ![]() U.
Obliczenia prowadzi się w oparciu o prawo Hessa wykorzystując standardowe
entalpie tworzenia zamieszczone w tabeli 1.
U.
Obliczenia prowadzi się w oparciu o prawo Hessa wykorzystując standardowe
entalpie tworzenia zamieszczone w tabeli 1.
Przykład 18.
Obliczyć standardową entalpię reakcji spalania etanu.
Rozwiązanie.
W zadaniu mowa jest o reakcji:
![]()
Zgodnie z prawem Hessa efekt cieplny reakcji spalania metanu pod stałym ciśnieniem (entalpia reakcji) nie zależy od drogi przemiany, a jedynie od stanu początkowego i końcowego układu. Stąd reakcję spalania można przeprowadzić na innej drodze, a efekt cieplny reakcji będzie ten sam. Dogodnym sposobem przeprowadzenia reakcji będzie rozkład substratów reakcji na pierwiastki i synteza produktów reakcji z pierwiastków. Należy pamiętać, że entalpia rozkładu związku chemicznego jest równa, co do wartości bezwzględnej entalpii tworzenia, a przeciwna, co do znaku. Zatem można zapisać trzy etapy:
1. rozkład 1 mola etanu na pierwiastki; entalpia tworzenia etanu wynosi –84,60 kJ/mol
![]()
2.
synteza 2 moli dwutlenku węgla z węgla i tlenu; entalpia tworzenia
CO2 wynosi
![]() kJ/mol
kJ/mol
![]()
3. synteza 3 moli wody w stanie pary; entalpia tworzenia H2O(g) = -241,60 kJ/mol
![]()
Dodając równania stronami wraz z entalpiami oraz redukując wyrażenia podobne otrzyma się w wyniku reakcję:
![]()
Spalaniu 1 mola etanu towarzyszy entalpia DHr = -1426,46 kJ. Znak minus oznacza, że układ traci energię, a więc jest to reakcja egzotermiczna.
Identyczny wynik uzyskuje się obliczając entalpię reakcji ze wzoru 2-5:
![]()
w którym DHj i DHi są entalpiami tworzenia substratów i produktów reakcji.
![]()
Obliczona entalpia –1426,46 kJ odnosi się do 1 mola etanu czyli wynosi –1426,46 kJ/mol
Odpowiedź
Standardowa entalpia spalania etanu wynosi –1426,46 kJ /mol
Przykład 19.
Obliczyć entalpię spalania 10,0 dm3 etynu (acetylen) odmierzonych w warunkach standardowych znając standardowe entalpie tworzenia:
etynu
![]() ,
,
dwutlenku
węgla
![]() ,
,
wody
![]() .
.
Rozwiązanie.
Etyn spala się w tlenie zgodnie z równaniem reakcji
![]()
Entalpie
reakcji można wyliczyć ze wzoru 2-5
![]()
![]()
Obliczona standardowa entalpia reakcji spalania odnosi się, zgodnie z zapisem reakcji, do 1 mola etynu. Traktując etyn jako gaz doskonały można obliczyć z prawa Clapeyrona ilość moli zawarte w 10,0 dm3 etynu odmierzonych w warunkach standardowych T = 298 K, p = 101 325 Pa.
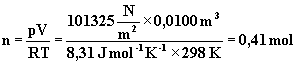
Efekt cieplny spalania 0,41 mola etynu równy jest 0,41 mol*(-1254,37 kJ/mol) = -514,29 kJ. Znak minus świadczy o tym, że reakcja ma charakter egzotermiczny.
Odpowiedź
Ciepło spalania 10 dm3 etynu wynosi -514,29 kJ.
Przykład 20
Obliczyć
standardową entalpię tworzenia cementytu
![]() znając entalpię reakcji:
znając entalpię reakcji:
![]()
Rozwiązanie
W
tabeli 1 podano standardowe entalpie tworzenia tlenku żelaza(III) i
dwutlenku węgla. Wynoszą one odpowiednio –822,2 kJ/mol oraz –393,13 kJ/mol.
Nieznaną wartość standardowej entalpii tworzenia cementytu oznaczoną
![]() można obliczyć stosując
prawo Hessa:
można obliczyć stosując
prawo Hessa:
![]()
Stąd
![]()
![]()
Odpowiedź
Standardowa entalpia tworzenia cementytu wynosi 20,90 kJ/mol
W
praktyce często charakteryzuje się paliwa za pomocą wartości
opałowej. Tym terminem określa się efekt cieplny
![]() reakcji spalania jednostkowej
ilości paliwa (1 kg dla paliw stałych i ciekłych, 1 m3 w
warunkach normalnych dla paliw gazowych). Wartość odnosi do temperatury
298 K, ale przyjmuje się, że para wodna nie uległa skropleniu.
reakcji spalania jednostkowej
ilości paliwa (1 kg dla paliw stałych i ciekłych, 1 m3 w
warunkach normalnych dla paliw gazowych). Wartość odnosi do temperatury
298 K, ale przyjmuje się, że para wodna nie uległa skropleniu.
Przykład 21.
Oblicz wartość opałową metanu.
Rozwiązanie.
Wartość opałowa metanu, to standardowa entalpia spalania 1 m3 (warunki normalne) metanu. Reakcja spalania metanu przebiega zgodnie z równaniem
![]()
Standardową entalpię spalania liczy się ze wzoru:
![]()
dla
1 mola metanu
![]()
Standardowa
entalpia spalania metanu wynosi –801,55 kJ/mol. W 1 m3 w
warunkach normalnych zawarte jest
![]() moli/m3 metanu. Zatem wartość opałowa wynosi –801,55 kJ/mol*
44,615 mol/m3 = -35761,15 kJ/m3. Znak minus stający
przed wynikiem informuje, że podczas reakcji układ stracił 35761,15 kJ
energii.
moli/m3 metanu. Zatem wartość opałowa wynosi –801,55 kJ/mol*
44,615 mol/m3 = -35761,15 kJ/m3. Znak minus stający
przed wynikiem informuje, że podczas reakcji układ stracił 35761,15 kJ
energii.
Odpowiedź
Wartość opałowa metanu wynosi ok. -35,8 MJ*m-3.
Uwaga! W
opracowaniach technicznych niekiedy znak minus jest opuszczany