2.1.4 II zasada termodynamiki
Powszechnie znany jest fakt, że w kontakcie dwóch ciał ogrzanych do różnych temperatur następuje przepływ ciepła od ciała bardziej nagrzanego do chłodniejszego. Jeśli między tymi ciałami temperatura się wyrówna, układ osiągnie stan równowagi i zakończy się samorzutny proces przepływu ciepła. Analogicznie zachodzą procesy dyfuzyjne samorzutnego mieszania się gazów czy wyrównywania stężeń. Układy takie dążą samorzutnie do stanu równowagi. W czasie przebiegu procesów samorzutnych następuje wzrost entropii. Dążność układu do osiągnięcia stanu równowagi można wykorzystać do uzyskania pracy. Z układu, który osiągnął stan równowagi nie można uzyskać pracy. II zasada termodynamiki jest uogólnieniem powyższych spostrzeżeń i dla układów fizykochemicznych może być sformułowana następująco:
W procesach przebiegających samorzutnie w kierunku osiągnięcia przez układ stanu równowagi rośnie entropia oraz maleje zdolność układu do wykonania pracy.
Zmiana entropii podczas przebiegu reakcji chemicznej może być wyrażona równaniem:
![]()
w którym Qodwr jest ciepłem przemiany odwracalnej, to znaczy takiej, w której proces jest ciągiem kolejnych stanów równowagowych. W przypadku przemian nieodwracalnych zmiana entropii jest większa od ilorazu ciepła przemiany i temperatury bezwzględnej.
![]()
Łącząc zapis I i II zasady termodynamiki można wyprowadzić definicję entalpii swobodnej G:
![]()
która jest kryterium równowagi dla procesów izotermiczno-izobarycznych.
Większość reakcji
chemicznych przebiega przy stałym ciśnieniu i przy stałej temperaturze.
Przebieg reakcji w tych warunkach charakteryzuje zmiana entalpii swobodnej ![]() G.
W procesie samorzutnym układ dąży do stanu charakteryzującego się
minimum energii i maksimum entropii. Samorzutnie biegną wszystkie reakcje
egzotermiczne, które charakteryzują się dodatnimi zmianami entropii. Stan
taki opisuje wartość
G.
W procesie samorzutnym układ dąży do stanu charakteryzującego się
minimum energii i maksimum entropii. Samorzutnie biegną wszystkie reakcje
egzotermiczne, które charakteryzują się dodatnimi zmianami entropii. Stan
taki opisuje wartość ![]() G,
która przyjmuje wówczas wartość ujemną. Należy zaznaczyć, że wartość
ujemna
G,
która przyjmuje wówczas wartość ujemną. Należy zaznaczyć, że wartość
ujemna ![]() G
wyznacza kierunek przemiany, ale nie informuje o szybkości reakcji
chemicznej. W stanie równowagi chemicznej
G
wyznacza kierunek przemiany, ale nie informuje o szybkości reakcji
chemicznej. W stanie równowagi chemicznej ![]() G
wynosi 0. Podczas takiej przemiany entalpia procesu jest równoważona
odpowiednimi zmianami entropii. W takim układzie nie obserwuje się
przebiegu reakcji chemicznej. Dodatnia wartość zmiany entalpii swobodnej
charakteryzuje reakcje, których przebieg samorzutny jest niemożliwy. W
szczególności należą do nich reakcje endotermiczne, przebiegające ze
zmniejszaniem się entropii. Samorzutnie będzie przebiegała reakcja w
kierunku przeciwnym.
G
wynosi 0. Podczas takiej przemiany entalpia procesu jest równoważona
odpowiednimi zmianami entropii. W takim układzie nie obserwuje się
przebiegu reakcji chemicznej. Dodatnia wartość zmiany entalpii swobodnej
charakteryzuje reakcje, których przebieg samorzutny jest niemożliwy. W
szczególności należą do nich reakcje endotermiczne, przebiegające ze
zmniejszaniem się entropii. Samorzutnie będzie przebiegała reakcja w
kierunku przeciwnym.
Obliczenia
entalpii swobodnej mają zatem duże znaczenie praktyczne. Zmianę entalpii
swobodnej ![]() G
podczas przebiegu reakcji chemicznej oblicza się zgodnie z równaniem:
G
podczas przebiegu reakcji chemicznej oblicza się zgodnie z równaniem:
![]()
Dla rozważanej w poprzednim paragrafie reakcji spalania etanu
![]()
zmiana entalpii swobodnej obliczona dla temperatury standardowej 298 K wynosi:
![]()
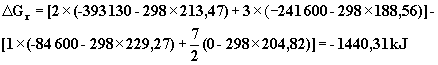
![]()
Ujemna wartość entalpii swobodnej świadczy o tym, że reakcja spalania etanu jest procesem samorzutnym. Przebieg reakcji odwrotnej to znaczy reakcji powstawania etanu z dwutlenku węgla i pary wodnej jest reakcją, której samorzutny przebieg jest niemożliwy.
Wartość
entalpii i entropii, a tym samym entalpii swobodnej zależy od temperatury.
Dokładne obliczenia termodynamiczne wymagają uwzględnienia wpływu
temperatury na wartość tych funkcji stanu. Obliczenie ![]() G
dla innej temperatury niż 298 K w oparciu o dane zamieszczone w tabeli 1 może
mieć jedynie charakter orientacyjny.
G
dla innej temperatury niż 298 K w oparciu o dane zamieszczone w tabeli 1 może
mieć jedynie charakter orientacyjny.