2.4 Entalpia swobodna i kierunek reakcji chemicznej
Obliczenia entalpii swobodnej maja duże znaczenie praktyczne, bowiem umożliwiają ocenę możliwości zajścia dowolnej reakcji chemicznej. Ujemna wartość entalpii swobodnej charakteryzuje przebieg reakcji samorzutnych. W warunkach równowagi izotermiczno-izobarycznej zmiana entalpii swobodnej wynosi zero. Dodatnia wartość entalpii swobodnej jest świadectwem niesamorzutności reakcji. Takie reakcje bez ingerencji z zewnątrz nie przebiegają.
Przykład 22.
Oblicz wartość entalpii swobodnej reakcji spalania wodoru w warunkach standardowych, znając standardowe entalpie i entropie reagentów (tabela 1 (V.2.1.3)).
Rozwiązanie
Standardową entalpię swobodną reakcji
![]()
oblicza się ze wzoru:
![]()
Należy
w tym celu obliczyć standardową entalpię reakcji
![]() oraz standardową entropię reakcji
oraz standardową entropię reakcji
![]() . Zatem
. Zatem
![]()
![]()
Standardowa entalpia swobodna wynosi:
![]()
Wartość standardowej entalpii swobodnej jest ujemna. Świadczy to o tym, że reakcja spalania wodoru przebiega samorzutnie. Czy to oznacza, że reakcja odwrotna, reakcja rozkładu wody jest niemożliwa? Nie, znaczy to jedynie, że reakcja odwrotna nie może przebiegać samorzutnie. Można przecież stworzyć warunki, w których przebiega rozkład wody na pierwiastki. Na przykład można to osiągnąć na drodze elektrolizy wody dostarczając energię do układu.
Odpowiedź
Entalpia swobodna reakcji spalania wodoru wynosi –228,40 kJ/mol
Przykład 23.
Określić kierunek przebiegu samorzutnej reakcji chemicznej
![]()
Aby rozstrzygnąć kierunek przebiegu reakcji chemicznej, należy wyliczyć wartość standardowej entalpii swobodnej zgodnie ze wzorem:
![]()
Stosując wartości standardowej entalpii tworzenia zestawione w tabeli
1 (V.2.1.3) można
obliczyć standardową entalpię reakcji:
![]()
Zmiana entropii wynosi
![]()
Zgodnie z definicją standardowej entalpii swobodnej w temperaturze 298 K jej wartość wynosi
![]()
Zmiana
entalpii swobodnej ma znak dodatni, co oznacza, że reakcja redukcji
tlenkiem węgla tlenku żelaza(III) w temperaturze 298 K nie jest
samorzutna. Samorzutnie przebiega reakcja odwrotna (reakcja dwutlenku węgla
z tlenkiem żelaza(II) i żelaza(III), przy czym wartość standardowej
entalpii swobodnej dla tej reakcji wynosi –12,09 kJ. Wartości liczbowe
entalpii swobodnej obu reakcji nie są odległe od stanu równowagi
chemicznej (![]() G
= 0), co świadczy, że prowadząc reakcję w warunkach
izotermiczno-izobarycznych w środowisku reakcji będą obecne wszystkie
cztery reagenty.
G
= 0), co świadczy, że prowadząc reakcję w warunkach
izotermiczno-izobarycznych w środowisku reakcji będą obecne wszystkie
cztery reagenty.
Odpowiedź
W
temperaturze 298 K reakcją samorzutną jest
![]()
Przykład 24.
Oszacować zmianę entalpii swobodnej reakcji z przykładu 5 w temperaturze 1500 K przyjmując wartości standardowej entalpii tworzenia i standardowej entropii.
Rozwiązanie.
Zgodnie
z tym, co zaznaczono w rozdziale 2.1.4, wartość funkcji termodynamicznych
zmienia się wraz z temperaturą w sposób, który zostanie wyjaśniony w
kursie chemii fizycznej. Orientacyjnie, z dużym marginesem błędu, można
założyć, że ![]() Hr
i
Hr
i ![]() Sr
nie ulega istotnej zmianie wraz z temperaturą i obliczyć
Sr
nie ulega istotnej zmianie wraz z temperaturą i obliczyć ![]() Gr
według znanej zależności w temperaturze 1500 K:
Gr
według znanej zależności w temperaturze 1500 K:
![]()
Otrzymana wartość szacunkowa pozwala stwierdzić, że entalpia swobodna przyjmie wartości ujemne i reakcja w temperaturze 1500 K będzie przebiegała samorzutnie.
Odpowiedź
Można
sądzić, że w temperaturze 1500 K reakcją samorzutną jest reakcja
![]()
Przykład 25.
Obliczyć wartości entalpii swobodnej w temperaturze 298 K i 1000 K reakcji spalania metanu znając wartości entalpii tworzenia i entropii w tych temperaturach:
|
Substancja |
Entalpia
tworzenia, |
Entropia,
ST, |
||
|
CH4(g) |
-74,78 |
-89,45 |
186,09 |
247,79 |
|
O2(g) |
0 |
0 |
204,82 |
243,23 |
|
CO2(g) |
-393,13 |
-394,26 |
213,47 |
268,90 |
|
H2O(g) |
-241,60 |
-247,62 |
188,56 |
232,45 |
Rozwiązanie
Spalanie metanu przebiega zgodnie z równaniem
![]()
W temperaturze 298 entalpia i entropia reakcji wynosi:
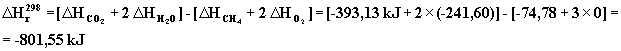
![]()
W temperaturze 1000 K wartości tych samych
funkcji termodynamicznych wynoszą odpowiednio:
![]()
![]()
Otrzymane wyniki można wykorzystać do obliczenia entalpii swobodnej w rozważanych temperaturach:
![]()
![]()
Łatwo zauważyć, że wartości entalpii reakcji spalania metanu nie zależą w istotnym stopniu od temperatury. Różnica entalpii w obydwóch temperaturach wynosi jedynie 1,50 kJ. Zmiany entropii są większe. W temperaturze 298 K wynosi – 5,14 J/K, a w 1000 K –0,45 J/K, ale obliczone na ich podstawie wartości entalpii swobodnej różnią się niewiele. Oznacza to, że dla jakościowego szacunku przebiegu reakcji chemicznej, w temperaturze innej niż standardowa, można stosować przybliżone obliczenia z zastosowaniem wartości standardowej entalpii i entropii.
Odpowiedź
Entalpia swobodna spalania metanu w temperaturze 298 K i 1000 K wynoszą około 800 kJ/mol.