3.2 Rozpuszczanie w wyniku solwatacji cząsteczek lub jonów
Solwatacją nazywamy oddziaływanie cząsteczek lub jonów danej substancji z cząsteczkami rozpuszczalnika w wyniku czego powstaje solwatowana forma cząsteczki (jonu). Forma ta jest przeważnie strukturą przestrzenną w której cząsteczka (jon) są otoczone ściśle zorientowanymi cząsteczkami rozpuszczalnika.
Charakter odziaływania cząsteczka (jon) – rozpuszczalnik zależy do budowy chemicznej cząsteczki i rozpuszczalnika. Przeważnie jest to oddziaływanie elektrostatyczne lub oddziaływanie poprzez siły dyspersyjne (II.1.3). W wyniku zjawiska solwatacji niejednorodny układ substancja rozpuszczana/rozpuszczalnik tworzy jednorodny układ jakim jest roztwór. Rys.3.1 przedstawia rozpuszczanie kryształu jonowego w wodzie w wyniku czego powstaje wodny roztwór tej soli składający się z jonów uwodnionych (solwatowanych).
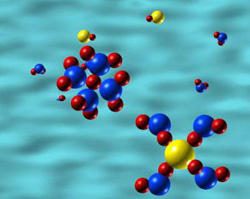
Kliknij na rysunek aby zobaczyć
animacje.
Rys.3.1 Uwodnione kationy i aniony powstają wskutek odziaływań elektrostatycznych kationów i anionów, z jakich jest zbudowana sieć jonowa kryształu z polarnymi cząsteczkami wody. Można zauważyć, że w uwodnionym anionie cząsteczki wody orientują się „biegunem dodatnim” – atomami wodoru, podczas gdy w uwodnionym kationie „biegunem ujemnym” – atomem tlenu.
Rysunek 3.2. ilustruje z kolei rozpuszczanie alkoholu w wodzie w wyniku odziaływań elektrostatycznych pomiędzy polarnymi cząsteczkami substancji rozpuszczanej -alkoholu i rozpuszczalnika – wody.
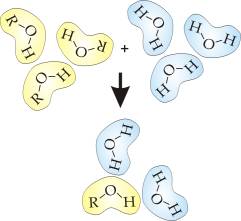
Rys.3.2. Rozpuszczanie alkoholu w wodzie. Polarne cząsteczki wody oddziaływują z polarną grupą OH alkoholu.
Im większa stała dielektryczna rozpuszczalnika, będąca miarą jego własności polarnych tym łatwiej rozpuszczają się w nim cząsteczki polarne lub kryształy jonowe. Rozpuszczalniki zbudowane z cząsteczek o słabych własnościach polarnych (niskiej stałej dielektrycznej) są natomiast dobrymi rozpuszczalnikami dla cząsteczek niepolarnych. Przykładem rozpuszczalnika „niepolarnego” jest czterochlorek węgla (rys.3.3). W cząsteczce tej cztery atomy chloru związane kowalentnie z centralnie położonym atomem węgla tworzą symetryczny czworościan. Tego typu ułożenie atomów chloru powoduje jednorodność ładunku na powierzchni bryły, pomimo istnienia polarnych wiązań C-Cl.
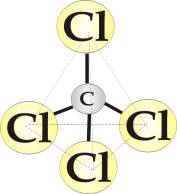
Rys.3.3. Model cząsteczki
czterochlorku węgla
![]()
Rozpuszczanie w rozpuszczalnikach niepolarnych zachodzi wskutek odziaływania sił dyspersyjnych.
W tablicy 3.1 przedstawiono stałe dielektryczne wybranych rozpuszczalników.
Tablica 3.1
|
Stałe
dielektryczne wybranych cieczy w temperaturze 200C |
||
|
Rozpuszczalnik |
Wzór
chemiczny |
Stała
dielektryczna |
|
Cyjanowodór |
HCN |
95,4 (210C) |
|
Kwas siarkowy VI |
|
84 |
|
Woda |
|
80 |
|
Glikol etylenowy |
|
41,2 |
|
Nitrobenzen |
|
36,1 |
|
Alkohol metylowy |
|
33,1 |
|
Aceton |
|
21,4 |
|
Alkohol izopropylowy |
|
15,6 |
|
Dwutlenek siarki |
|
15,6 (210C) |
|
Amoniak |
|
15,5 (20,50C) |
|
Fenol |
|
9,9 (480C) |
|
Kwas octowy |
|
7,14 (170C) |
|
Siarkowodór |
|
5,75
(100C) |
|
Chloroform |
|
5,05 |
|
Eter
dwuetylowy |
|
4,34 |
|
Trójchlorek
fosforu |
|
3,72 (180C) |
|
Dwusiarczek węgla |
|
2,65 |
|
Toluen |
|
2,4 |
|
Czterochlorek krzemu |
|
2,4 |
|
Benzen |
|
2,28 |
|
Czterochlorek węgla |
|
2,24 |
|
Próżnia |
|
1 (z definicji) |