4.3 Destylacja
Destylacją nazywamy metodę rozdzielenia składników tworzących roztwór opartą na zjawisku wzbogacenia pary nad wrzącym roztworem w składnik bardziej lotny. Rys. 4.4. przedstawia proste urządzenie do destylacji. Para powstała w czasie wrzenia roztworu ulega skropleniu w chłodnicy i jest zbierana w naczyniu odbierającym („odbieralniku”). Tworzący się w ten sposób kondensat jest wzbogacony w ciecz o większej lotności. Rys. 4.5 przedstawia wykres fazowy dla roztworu stałego dwóch cieczy A i B. Destylacja tego roztworu w temperaturze T1 pozwala na otrzymanie cieczy wzbogaconej o bardziej lotny składnika B (patrz skład pary w punkcie 1). W trakcie destylacji wrząca ciecz wzbogaca się w mniej lotny składnik A w związku z czym temperatura wrzenia roztworu przesuwa się w kierunku wyższych temperatur (patrz strzałka na krzywej wrzenia). Temperatura kondensacji (skraplania) również przesuwa się w kierunku wyższych temperatur, ponieważ pary zawierają coraz więcej składnika A.
Destylacja prowadzona w warunkach izotermicznych (w stałej temperaturze) pozwala na uzyskanie kondensatu (destylatu) o pożądanym składzie. Destylacja jest metodą rozdziału cieczy bardzo często stosowaną w technologii chemicznej. Pozwala ona niekiedy na rozdział bardzo złożonych substancji.
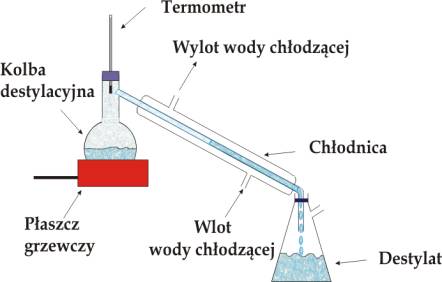
Rys.4.4. Schemat prostego zestawu laboratoryjnego do destylacji
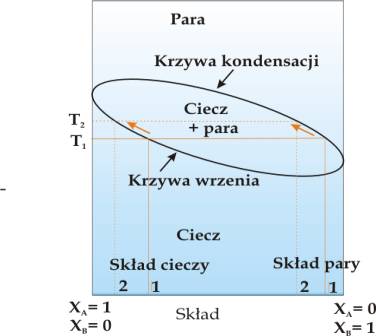
Rys.4.5. Krzywe wrzenia i kondensacji dla dwuskładnikowego roztworu doskonałego substancji A i B. W temperaturze wrzenia T1 skład cieczy i pary odpowiadają punktom 1 na osi składu. W wyniku destylacji skład cieczy wzbogaca się w mniej lotny składnik A (punkt 2 na osi składu) co powoduje wzrost temperatury wrzenia do wartości T2 oraz wzbogacenie składu pary w składnik A.