4.5 Temperatura wrzenia i krzepnięcia roztworu
Temperatura
krzepnięcia i wrzenia roztworu doskonałego zależy od jego składu. Wzrost
stężenia powoduje wzrost
temperatury wrzenia i obniżenie temperatury krzepnięcia roztworu.
Równania 4.06 i 4.07 ilustrują zależność pomiędzy wzrostem
temperatury wrzenia
![]() i obniżeniem temperatury
krzepnięcia
i obniżeniem temperatury
krzepnięcia
![]() a stężeniem
molarnym (VI.2.5) roztworu:
a stężeniem
molarnym (VI.2.5) roztworu:
podwyższenie
temperatury wrzenia (4.06)
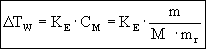
obniżenie
temperatury krzepnięcia (4.07)
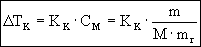
gdzie:
m jest masą substancji rozpuszczonej wyrażoną w [g],
M masą molową substancji rozpuszczonej [g],
mr masą rozpuszczalnika.
Stałe
KE i KK noszą nazwę stałej
ebulioskopowej i stałej krioskopowej. Są one wielkościami
charakterystycznymi dla danego rozpuszczalnika. Można zauważyć, że stałe
KE i KK są równe wartościom
![]() i
i
![]() jeśli w 1000g danego
rozpuszczalnika rozpuścimy jeden mol substancji (
jeśli w 1000g danego
rozpuszczalnika rozpuścimy jeden mol substancji (
![]() ). Stałe ebulioskopowe i stałe krioskopowe dla wybranych rozpuszczalników
przedstawiono w tablicy 4.1.
). Stałe ebulioskopowe i stałe krioskopowe dla wybranych rozpuszczalników
przedstawiono w tablicy 4.1.
Tablica 4.1
|
Stałe
ebulioskopowe i stałe krioskopowe dla wybranych rozpuszczalników |
|||
|
Rozpuszczalnik |
Wzór chemiczny |
|
|
|
Woda |
|
0,512 |
1,86 |
|
Benzen |
|
2,53 |
4,90 |
|
Nitrobenzen |
|
5,24 |
7,00 |
|
Bifenyl |
|
- |
8,00 |
|
Dibromoeten |
|
- |
11,80 |
|
Naftalen |
|
- |
6,8 |
|
Dwusiarczek węgla |
|
2,34 |
- |
|
Czterochlorek węgla |
|
5,03 |
32 |
|
Alkohol etylowy |
|
1,22 |
- |
|
Alkohol metylowy |
|
0,83 |
|