Proces
rozpuszczania trudno
rozpuszczalnej substancji jonowej można przedstawić jako
równowagę pomiędzy substancją w postaci ciała stałego (osadu -
![]() ) a jonami tej substancji obecnymi w roztworze (
) a jonami tej substancji obecnymi w roztworze (
![]() ):
):
Stałą równowagi tego procesu można opisać równaniem:
(5.30)
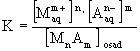
Stężenie
![]() jest dla układu trudno
rozpuszczalna substancja jonowa / roztwór praktycznie stałe, gdyż
roztwór zawsze pozostaje w równowadze z osadem o stałej koncentracji
substancji. Możemy zatem przekształcić równanie (5.30) grupując wartości
stałe po lewej stronie równania:
jest dla układu trudno
rozpuszczalna substancja jonowa / roztwór praktycznie stałe, gdyż
roztwór zawsze pozostaje w równowadze z osadem o stałej koncentracji
substancji. Możemy zatem przekształcić równanie (5.30) grupując wartości
stałe po lewej stronie równania:
(5.31)
![]()
Iloczyn:
![]() zwany iloczynem rozpuszczalności
jest wielkością stałą w określonych warunkach ciśnienia i temperatury,
charakterystyczną dla danego układu trudno rozpuszczalna substancja
jonowa / rozpuszczalnik.
zwany iloczynem rozpuszczalności
jest wielkością stałą w określonych warunkach ciśnienia i temperatury,
charakterystyczną dla danego układu trudno rozpuszczalna substancja
jonowa / rozpuszczalnik.
Innymi słowy iloczynem rozpuszczalności nazywamy iloczyn stężeń jonowych danej substancji jonowej w roztworze nasyconym:
(5.32)
![]()
Tablica 5.2. przedstawia iloczyny rozpuszczalności wybranych substancji jonowych w roztworach wodnych.Tablica 5.2.
|
Iloczyny
rozpuszczalności wybranych elektrolitów w roztworach wodnych w
temperaturze 200C |
|||
Sól
|
Równowaga |
Wyrażenie
iloczynu rozpuszczalności L |
Wartość
iloczynu rozpuszczalności L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Iloczyn jonowy charakteryzuje stężenie jonów w roztworze pozostającym w równowadze z osadem, a więc w roztworze nasyconym. Jest więc miarą rozpuszczalności danej substancji jonowej.
Jeżeli iloczyn stężeń jonowych trudno rozpuszczalnego elektrolitu w roztworze jest większy niż iloczyn rozpuszczalności tego elektrolitu:
![]()
to z roztworu wytrącać się będzie osad aż do momentu
kiedy iloczyn ten nie osiągnie wartości równej iloczynowi rozpuszczalności
![]() .
.
Jeśli iloczyn ten jest mniejszy niż iloczyn rozpuszczalności:
![]()
substancja rozpuszcza się całkowicie w roztworze (roztwór nienasycony).
Zależności powyższe wynikają z przesunięć równowagi i dążenia układu do zachowania stałej równowagi w równaniu (5.30).
Własności
wodnych roztworów trudno rozpuszczalnej soli
![]() , której iloczyn rozpuszczalności
wynosi
, której iloczyn rozpuszczalności
wynosi
![]() , ilustruje tablica 5.3.
, ilustruje tablica 5.3.
 Tablica
5. 3.
Tablica
5. 3.
Niekiedy można uzyskać roztwory o stężeniach większych niż wynosi rozpuszczalność danej substancji w roztworze (przekroczony iloczyn rozpuszczalności). Roztwory takie noszą nazwę roztworów przesyconych. Są one układami nierównowagowymi i termodynamicznie nietrwałymi. Roztwory takie będą dążyć do powrotu do równowagi i z biegiem czasu wytrąci się z nich osad.