5.6 Kwasy i zasady
5.6.1
Definicja Brönsteda i Lowry’ego
W
1923 roku Brönsted i Lowry ogłosili niezależnie od siebie teorię kwasów
i zasad opartą na mechanizmie odszczepiania i przyłączenia jonu
wodorowego przez różne substancje. Zgodnie z tą
teorią kwasem nazywamy substancję, która ma zdolność odszczepienia
protonu (jonu wodorowego), natomiast zasadą substancję, która ma zdolność
przyłączenia protonu.
Definicję Brönsteda i
Lowry’ego można opisać następująco:
(5.40)
![]()
Równowaga kwasowo-zasadowa Brönsteda i Lowry’ego zakłada, że z każdym kwasem musi być sprzężona jakaś zasada. Ilustrują to poniżej przedstawione przykłady:
(5.41)
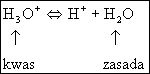
(5.42)
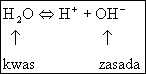
(5.43)
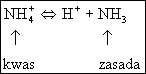
(5.44)
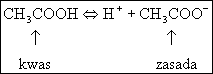
Porównując równania (5.41) i (5.42) widzimy, że cząsteczka wody w reakcji (5.41) jest zasadą natomiast w reakcji (5.42) jest kwasem. Tego rodzaju substancje, które mogą wykazywać zarówno własności kwasowe jak i zasadowe nazywamy substancjami amfoterycznymi (amfoterami).