5.6.2
Skala kwasowości, pH
Miarą
kwasowości roztworu jest stężenie jonów wodorowych
![]() . Granice tego stężenia wyznaczone są wielkościami stałych dysocjacji
odpowiednich równowag auto-dysocjacji poszczególnych rozpuszczalników. Jeśli
rozpuszczalnikiem jest woda to z iloczynu jonowego wody (5.39)
wynika, że stężenie jonów wodorowych może się zmieniać w przedziale
od 0 do 14. Dla czystej wody stężenie jonów wodorowych jest równe stężeniu
jonów hydroksylowych co wynika z reakcji dysocjacji wody (5.36).
Łatwo zatem zauważyć, że stężenie to musi wynosić
. Granice tego stężenia wyznaczone są wielkościami stałych dysocjacji
odpowiednich równowag auto-dysocjacji poszczególnych rozpuszczalników. Jeśli
rozpuszczalnikiem jest woda to z iloczynu jonowego wody (5.39)
wynika, że stężenie jonów wodorowych może się zmieniać w przedziale
od 0 do 14. Dla czystej wody stężenie jonów wodorowych jest równe stężeniu
jonów hydroksylowych co wynika z reakcji dysocjacji wody (5.36).
Łatwo zatem zauważyć, że stężenie to musi wynosić
![]() :
:
(5.45)
![]()
Roztwór w którym stężenie jonów wodorowych jest równoważne stężeniu jonów hydroksylowych nazywamy roztworem obojętnym.
Wyrażenie (5.39) można przedstawić w postaci logarytmicznej:
(5.46)
![]()
Wprowadzając za Sörensenem oznaczenia:
(5.47)
![]()
(5.48)
![]()
otrzymujemy:
(5.49)
![]()
Wartość pH jest powszechnie przyjętą miarą kwasowości roztworów. W rozcieńczonych roztworach wodnych (roztworach doskonałych) może ona przyjmować wartości od 0 do 14 (rys.5.6)
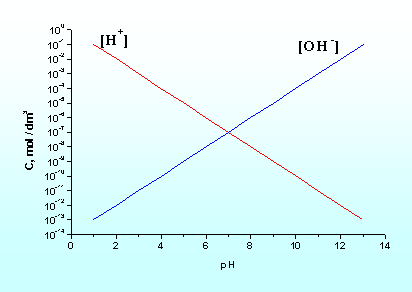
Rys.5.6. Graficzny wykres zależności
między pH a stężeniem jonów wodorowych
![]() i hydroksylowych
i hydroksylowych
![]() .
.
Dla roztworów rzeczywistych
definicję pH należy wyrazić poprzez aktywność jonów wodorowych
![]() :
:
(5.50)
![]()
Należy podkreślić, że skala kwasowości pH jest ściśle związana z wielkością stałej równowagi auto-dysocjacji danego rozpuszczalnika. Nie ma uniwersalnej skali pH mającej zastosowanie we wszystkich rozpuszczalnikach. Każdemu rozpuszczalnikowi można przypisać inną skalę pH co przedstawiono na rys.5.7.
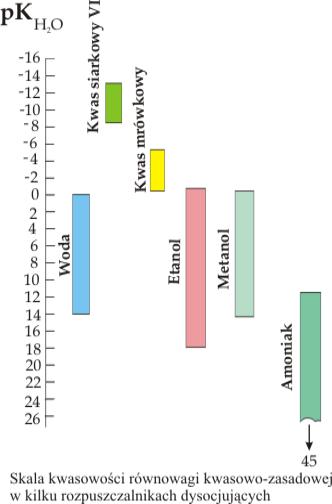
Rysunek 5.7