5.6.3 Pomiar pH
Najprostszym sposobem pomiaru pH jest pomiar przy pomocy wskaźników (indykatorów). Wskaźniki są to przeważnie słabe kwasy lub zasady organiczne, których cząsteczka w postaci niezdysocjowanej ma inne zabarwienie niż powstający w wyniku dysocjacji produkt. Przykładem może być oranż metylowy którego postać niezdysocjowana ma kolor czerwony, a postać zdysocjowana żółty:
(5.51)
HR
![]() H+ +
R-
H+ +
R-
W środowisku kwaśnym równowaga (5.51) będzie przesunięta w lewo i roztwór zabarwi się na czerwono. W środowisku zasadowym równowaga przesunie się w kierunku odwrotnym – w kierunku żółtego zabarwienia. W tablicy 5.5 podano przykłady kilku indykatorów oraz odpowiadające im zakresy zmiany zabarwienia.
Tablica 5.5.
|
Ważniejsze
wskaźniki kwasowo-zasadowe |
|||
|
Wskaźnik |
Barwa
wskaźnika w roztworze |
Zakres
pH, w którym następuje zmiana barwy |
|
|
o
pH niższym od zakresu zmiany |
o
pH wyższym od zakresu zmiany |
||
|
Błękit
tymolowy |
czerwona |
fioletowa |
1,2
- 2,8 |
|
Oranż
metylowy |
czerwona |
żółta |
3,1
– 4,4 |
|
Czerwień
metylowa |
czerwona |
żółta |
4,2
– 6,0 |
|
Błękit
bromotymolowy |
żółta |
niebieska |
6,0
– 7,6 |
|
Lakmus |
czerwona |
niebieska |
5,0
– 8,0 |
|
Fenoloftaleina |
bezbarwna |
czerwona |
8,3
– 10,0 |
Do pomiarów pH stosuje się często uniwersalne papierki wskaźnikowe będące mieszaniną różnych wskaźników naniesionych na cienką bibułę. Zanurzenie papierka w badanym roztworze i porównanie jego barwy ze skalą (rys. 5.8) pozwala na określenie wartości pH.
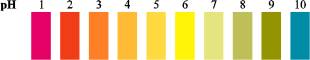
Rys.5.8. Skala barw wskaźnika uniwersalnego.
Elektrochemiczny
pomiar pH
Innym bardziej dokładnym pomiarem pH jest pomiar elektrochemiczny. W pomiarze tym wykorzystuje się liniową zależność potencjału niektórych elektrod, na przykład elektrody wodorowej, od pH roztworu. Zależność ta wynika z równania Nernsta dla elektrody wodorowej:
(5.52)
![]()
(5.53)
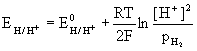
Dla warunków normalnych:
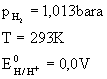
amy:
(5.54)
![]()
Zależność opisaną równaniem (5.54) przedstawiono na rysunku 5.9. Pozwala ona na odczytanie wartości pH z pomiaru potencjału elektrody wodorowej zanurzonej w badanym roztworze. Metody elektrochemiczne pozwoliły na konstrukcję pH-metrów tj. przyrządów pozwalających na precyzyjny pomiar pH.
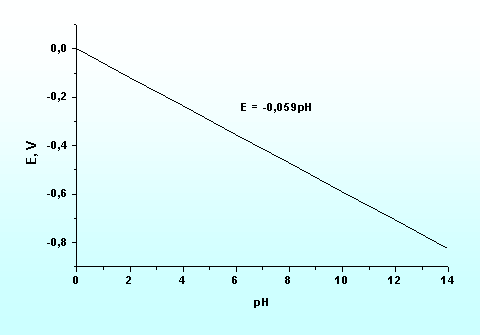
Rys. 5.9. Zależność potencjału elektrody wodorowej od pH.