5.6.6
Elektronowa
teoria Lewisa
Głębsza analiza reakcji protolitycznych ( z udziałem jonu wodorowego) pozwala zauważyć, że zasadami są przeważnie cząsteczki, atomy lub jony bogate w wolne pary elektronowe. Efekt ten jest widoczny w oddziaływaniu cząsteczki wody i cząsteczki amoniaku z jonem wodorowym. Reakcje równowagowe:
(5.55)
![]()
(5.56)
![]()
można zilustrować tworzeniem wiązania koordynacyjnego pomiędzy zasadą, cząsteczką wody i amoniaku, a jonem wodorowym:
(5.57)
![]()
(5.58)
![]()
Lewis
scharakteryzował kwasy jako substancje będące akceptorami pary
elektronowej, natomiast zasady jako substancje będące donorami pary
elektronowej.
Zgodnie z koncepcją
Lewisa zasadami w równaniach (5.55, 5.57) i (5.56, 5.58) są cząsteczki
wody i amoniaku podobne jak w teorii Brönsteda. Kwasem jest natomiast jon
wodorowy (w teorii Brönsteda jon
![]() ).
).
Koncepcja Lewisa ma bardziej uniwersalny charakter i dotyczy nie tylko reakcji protolitycznych ( reakcji z udziałem jonu wodorowego). Na rysunku 5.10 przedstawiono przykłady równowag kwasowo-zasadowych opisanych teorią Lewisa.
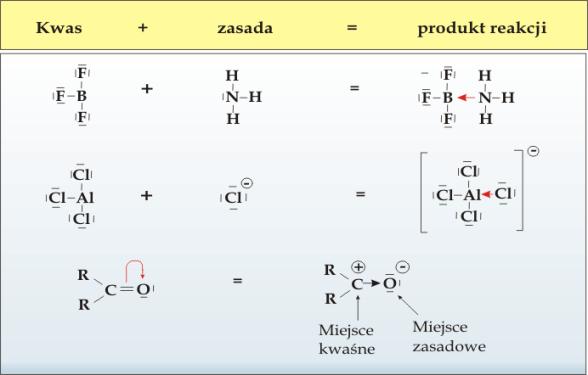
Rys.5.10. Równowagi kwasowo-zasadowe według koncepcji Lewisa.