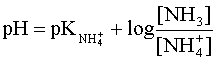5.8
Roztwory
buforowe
Roztworami
buforowymi nazywamy roztwory zachowujące stałą wartość pH i nieczułe
na niewielkie dodatki kwasów i zasad. Są to przeważnie roztwory słabych
kwasów i ich soli lub słabych zasad i ich soli.
Działanie
roztworu buforowego sporządzonego w oparciu o słaby kwas HA i sprzężony
z tym kwasem anion
![]() (zasadę zgodnie z definicją
Brönsteda) polega wiązaniu nadmiaru jonów
(zasadę zgodnie z definicją
Brönsteda) polega wiązaniu nadmiaru jonów
![]() w wyniku reakcji:
w wyniku reakcji:
(5.90a)
![]()
(5.90b)
![]()
pH
takiego roztworu buforowego możemy ustalić dobierając odpowiednio stężenie
słabego kwasu HA i sprzężonej z nim zasady
![]() posługując się stałą równowagi dla reakcji dysocjacji kwasu:
posługując się stałą równowagi dla reakcji dysocjacji kwasu:
(5.91)
![]()
(5.92)
![]()
(5.93)
![]()
(5.94)
![]()
Z
definicji:
![]() mamy:
mamy:
(5.95)
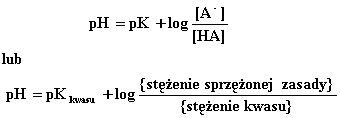
Przykłady
Bufor
octanowy
Bufor
octanowy składa się z kwasu octowego
![]() i jego soli na przykład octanu
sodowego
i jego soli na przykład octanu
sodowego
![]() . Działanie buforujące tego roztworu polega na wiązaniu
namiaru jonów wodorowych zgodnie z reakcją:
. Działanie buforujące tego roztworu polega na wiązaniu
namiaru jonów wodorowych zgodnie z reakcją:
![]()
(5.96a)
![]()
oraz wiązaniu nadmiaru jonów hydroksylowych:
(5.96b)
![]()
W ten sposób roztwór zachowuje stałą wartość pH pomimo niewielkich dodatków kwasu lub zasady. pH buforu octanowego dane jest równaniem:
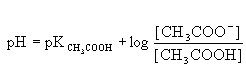
![]()
Roztwór
zawierający
![]()
![]() oraz
oraz
![]()
![]() będzie miał kwasowość:
będzie miał kwasowość:
![]()
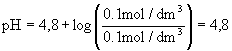
Stała
dysocjacji kwasu octowego wynosi:
![]() .
.
Bufor
amonowy
Roztwory zawierające sole amonowe i wodny roztwór amoniaku mają własności buforowe:
![]() wiązanie jonów wodorowych
wiązanie jonów wodorowych
![]() wiązanie jonów hydroksylowych
wiązanie jonów hydroksylowych
Kwasowość roztworu buforowego dana jest wyrażeniem: