5.7.3
Hydroliza
soli słabych kwasów i słabych zasad
(przykłady)
Hydrolizę
soli słabego kwasu
![]() i słabej zasady
i słabej zasady
![]() można opisać reakcją
dysocjacji (wszystkie sole rozpuszczone w wodzie są całkowicie
zdysocjowane):
można opisać reakcją
dysocjacji (wszystkie sole rozpuszczone w wodzie są całkowicie
zdysocjowane):
(5.81)
![]()
reakcją anionu z cząsteczką wody:
(5.82)
![]()
oraz reakcją kationu z cząsteczką wody:
(5.83)
![]()
Obu reakcjom cząstkowym (5.82) i (5.83) można przypisać stałe hydrolizy Kh1 i Kh2 stosując wzory (5.69, 5.70) oraz (5.77, 5.78). Sumaryczną reakcję hydrolizy można uzyskać poprzez dodanie reakcji (5.82) i (5.83):
(5.84)
![]()
Stała równowagi dla reakcji (5.84) wynosi:
(5.85)
![]()
Równanie (5.85) możemy przedstawić w postaci:
(5.86)
![]()
Przyjmując,
że:
![]() oraz mnożąc licznik i mianownik przez iloczyn
oraz mnożąc licznik i mianownik przez iloczyn
![]() mamy:
mamy:
(5.87)
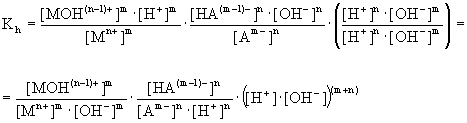
Stąd po podstawieniu odpowiednich stałych,
iloczynu
jonowego wody:
![]()
stałej
dysocjacji słabej zasady
![]() :
:
![]()
stałej
dysocjacji słabego kwasu
![]() :
:
![]()
otrzymamy wyrażenie na stałą hydrolizy soli słabego kwasu i słabej zasady:
(5.88)
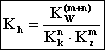
W wyniku hydrolizy soli słabego kwasu i słabej zasady odczyn roztworu (pH) zależy od wielkości odpowiednich stałych dysocjacji kwasu i zasady.
Przykład
hydrolizy soli słabego kwasu i słabej zasady:
Hydroliza
octanu amonowego
Octan
sodowy jest solą słabego kwasu octowego
![]() i słabej zasady
amonowej
i słabej zasady
amonowej
![]() . Hydroliza tej soli przebiega zgodnie z reakcjami:
. Hydroliza tej soli przebiega zgodnie z reakcjami:
(5.89a)
![]()
(sól jest całkowicie zdysocjowana w roztworze wodnym)
(5.89b)
![]()
(anion octanowy ma tendencję przyłączania jonu wodorowego)
(5.89c)
![]()
(kation amonowy przyłącza jon hydroksylowy)
Reakcja całkowita:
(5.89d)
![]()