5.7.2 Hydroliza soli słabych kwasów i mocnych zasad (przykłady)
Hydrolizę
soli słabego kwasu
![]() i mocnej zasady
i mocnej zasady
![]() można opisać reakcją
dysocjacji (wszystkie sole rozpuszczone w wodzie są całkowicie
zdysocjowane):
można opisać reakcją
dysocjacji (wszystkie sole rozpuszczone w wodzie są całkowicie
zdysocjowane):
(5.73)
![]()
oraz reakcją anionu z cząsteczkami wody:
(5.74)
![]()
Reakcja (5.74) jest reakcją równowagową i można jej przypisać stałą równowagi K:
(5.75)
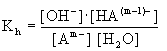
Przyjmując,
że stężenie wody
![]() jest praktycznie stałe możemy
równanie (5.75) przekształcić:
jest praktycznie stałe możemy
równanie (5.75) przekształcić:
(5.76)
![]()
Jeśli
pomnożymy mianownik i licznik przez
![]() to otrzymamy wyrażenie:
to otrzymamy wyrażenie:
Ponieważ
iloczyn:
![]() jest iloczynem jonowym wody, a wyrażenie:
jest iloczynem jonowym wody, a wyrażenie:
![]() jest stałą dysocjacji słabego
kwasu
jest stałą dysocjacji słabego
kwasu
![]() mamy po podstawieniu do równania
(5.77):
mamy po podstawieniu do równania
(5.77):
Z równania (5.78) wynika że stała hydrolizy soli słabego kwasu i mocnej zasady jest ilorazem iloczynu jonowego wody i stałej dysocjacji słabego kwasu, który powstaje w wyniku hydrolizy.
Przykłady
hydrolizy soli słabego kwasu i mocnej zasady:
Hydroliza
octanu sodowego
Octan
sodowy jest solą słabego kwasu octowego
![]() i mocnej zasady
sodowej NaOH. Hydroliza tej soli przebiega zgodnie z reakcjami:
i mocnej zasady
sodowej NaOH. Hydroliza tej soli przebiega zgodnie z reakcjami:
(5.79a)
![]()
(sól jest całkowicie zdysocjowana w roztworze wodnym)
(5.79b)
![]()
(anion octanowy reaguje z cząsteczką wody przyłączając jon wodorowy)
Reakcja całkowita:
(5.79c)
![]()
Hydroliza węglanu
sodowego
Węglan
sodowy jest solą mocnej zasady sodowej NaOH i słabego kwasu węglowego
![]() . Hydrolizę tej soli opisują reakcje:
. Hydrolizę tej soli opisują reakcje:
(5.80a)
![]()
(5.80b)
![]()
Reakcja sumaryczna:
(5.80c)
![]()