5.7.1
Hydroliza soli mocnych
kwasów i słabych zasad (przykłady)
Hydrolizę
soli mocnego kwasu
![]() i słabej zasady
i słabej zasady
![]() można opisać reakcją
dysocjacji (wszystkie sole rozpuszczone w wodzie są całkowicie
zdysocjowane):
można opisać reakcją
dysocjacji (wszystkie sole rozpuszczone w wodzie są całkowicie
zdysocjowane):
(5.65)
![]()
oraz reakcją kationu z cząsteczkami wody:
(5.66)
![]()
Reakcja (5.66) jest reakcją równowagową i można jej przypisać stałą równowagi K:
(5.67)
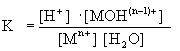
Przyjmując,
że stężenie wody
![]() jest praktycznie stałe i
oznaczając iloczyn
jest praktycznie stałe i
oznaczając iloczyn
![]() stałą hydrolizy Kh
możemy równanie (5.67) zapisać w postaci:
stałą hydrolizy Kh
możemy równanie (5.67) zapisać w postaci:
(5.68)
![]()
Jeśli
pomnożymy mianownik i licznik przez
![]() to otrzymamy wyrażenie:
to otrzymamy wyrażenie:
Ponieważ
iloczyn:
![]() jest iloczynem jonowym wody, a wyrażenie:
jest iloczynem jonowym wody, a wyrażenie:
![]() jest stałą dysocjacji słabej
zasady
jest stałą dysocjacji słabej
zasady
![]() mamy po podstawieniu do równania
(5.69):
mamy po podstawieniu do równania
(5.69):
Z równania (5.70) wynika że stała hydrolizy soli mocnego kwasu i słabej zasady jest ilorazem iloczynu jonowego wody i stałej dysocjacji słabej zasady, która powstaje w wyniku hydrolizy.
Przykłady
hydrolizy soli mocnego kwasu i słabej zasady:
Hydroliza
chlorku amonu
Chlorek
amonu
![]() jest solą mocnego kwasu solnego HCl i słabej zasady amonowej
jest solą mocnego kwasu solnego HCl i słabej zasady amonowej
![]() . Reakcję hydrolizy tej soli w roztworach wodnych można przedstawić następująco:
. Reakcję hydrolizy tej soli w roztworach wodnych można przedstawić następująco:
(5.71a)
![]() (sól w wodzie jest całkowicie
zdysocjowana)
(sól w wodzie jest całkowicie
zdysocjowana)
(5.71b)
![]() (kation amonowy reaguje
z cząsteczką wody odszczepiając
z niej jon wodorowy)
(kation amonowy reaguje
z cząsteczką wody odszczepiając
z niej jon wodorowy)
Po dodaniu równań (5.71a i b) otrzymamy reakcję sumaryczną:
(5.71c)
![]()
Hydroliza
siarczanu VI glinu
Siarczan
VI glinu jest solą mocnego kwasu siarkowego VI
![]() i słabej zasady
i słabej zasady
![]() .
.
Hydroliza tej soli przebiega zgodnie z reakcjami:
(5.72a)
![]()
(5.72b)
![]()
(5.72c)
![]()