5.7
Hydroliza
soli
Hydrolizą
nazywamy reakcję jonów z cząsteczkami wody w wyniku której następuje rozkład cząsteczki
wody z uwolnieniem jonu wodorowego lub hydroksylowego. Następuje zatem
zakwaszenie lub alkalizacja roztworu wodnego.
Reakcję hydrolizy można opisać schematycznie następującymi równaniami:
(5.63)
![]()
(5.64)
![]()
W
przypadku pierwszej reakcji oddziaływanie kationów
![]() z cząsteczkami wody prowadzi
do powstania słabo zdysocjowanego produktu
z cząsteczkami wody prowadzi
do powstania słabo zdysocjowanego produktu
![]() i jonów wodorowych
i jonów wodorowych
![]() . Roztwór ulegnie zakwaszeniu.
. Roztwór ulegnie zakwaszeniu.
Druga
reakcja anionów
![]() z wodą prowadzi
do powstania słabo produktu
z wodą prowadzi
do powstania słabo produktu
![]() i wolnych jonów hydroksylowych
i wolnych jonów hydroksylowych
![]() a więc roztwór ulegnie
alkalizacji.
a więc roztwór ulegnie
alkalizacji.
Reakcja hydrolizy kationów jest wynikiem silnego oddziaływania wolnych par elektronowych cząsteczki wody z dodatnio naładowanym kationem (rys.5.11).
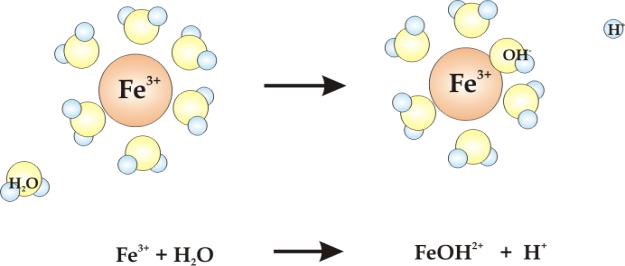
Rys.5.11. Hydroliza kationu Fe3+ w roztworze wodnym.
Oddziaływanie
to jest tym silniejsze im większa jest gęstość ładunku dodatniego na
powierzchni kationu. Dużą gęstość będą posiadały małe kationy o dużym
ładunku, na przykład kation
![]() . Z dwóch kationów żelaza
. Z dwóch kationów żelaza
![]() i
i
![]() kation żelaza III będzie łatwiej ulegał hydrolizie niż kation żelaza
II. Kation ten posiada bowiem większą gęstość ładunku.
kation żelaza III będzie łatwiej ulegał hydrolizie niż kation żelaza
II. Kation ten posiada bowiem większą gęstość ładunku.
Podobnie
siła oddziaływania anionów z cząsteczkami wody będzie zależała od siły
oddziaływania wolnych par
elektronowych anionu z atomem wodoru cząsteczki wody. (rys.5.12)
.
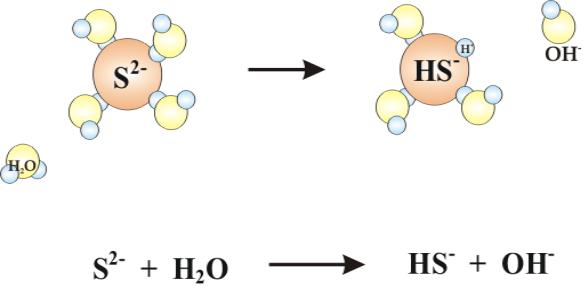
Rys.5.12. Hydroliza anionu S2- w roztworze wodnym.