Jak Geolog może wykorzystać wiedzę o jądrze atomowym i przemianach jądrowych?
| Strona: | Open AGH - Otwarte Zasoby Edukacyjne |
| Kurs: | Elementy chemii nieorganicznej dla geologów |
| Książka: | Jak Geolog może wykorzystać wiedzę o jądrze atomowym i przemianach jądrowych? |
| Wydrukowane przez użytkownika: | Gość |
| Data: | piątek, 30 stycznia 2026, 20:09 |
Spis treści
- 1. Składniki atomu
- 2. Izotopy
- 3. Jądro atomowe
- 3.1. Przemiany jądrowe
- 3.2. Przemiany naturalne
- 3.3. Sztuczne przemiany jądrowe
- 3.4. Szybkość rozpadu promieniotwórczego i okres półtrwania
- 3.5. Szeregi promieniotwórcze
- 3.6. Zastosowania promieniotwórczości
- 3.7. Izotopowy zapis przeszłości Ziemi
- 3.8. Czy należy bać się promieniotwórczości?
- 3.9. Energetyka jądrowa
- 4. Bibliografia
1. Składniki atomu
Oglądnij film przedstawiający współczesną teorię budowy atomu, wprowadzi Cię on w zagadnienia poruszane w tym temacie.
Film: Współczesny opis budowy atomu*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
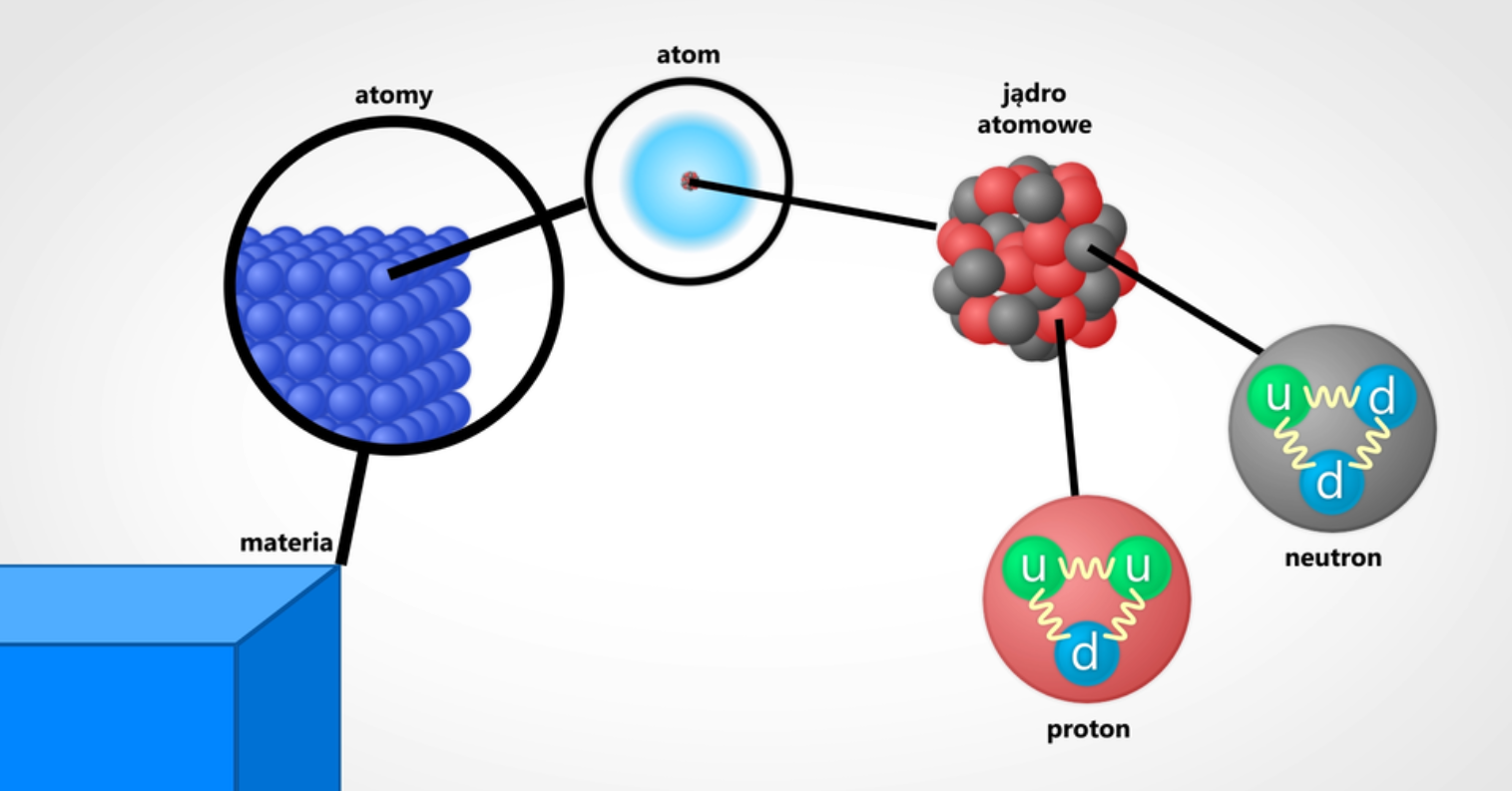
Atomy składają się z trzech rodzajów cząstek subatomowych, są to
protony, neutrony i elektrony. Protony i neutrony są łącznie nazywane
nukleonami.
Grafika: Model budowy atomu*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
W geometrycznym środku atomu znajduje się dodatnio naładowane jądro
atomowe zbudowane z protonów i neutronów. Jądro atomowe jest bardzo małe w porównaniu z rozmiarami całego atomu (rozmiary atomu są rzędu 10-10
m ) i ma wymiary rzędu 10-14–10-15 m, jest przy tym bardzo
ciężkie, jego masa stanowi 99,99% masy atomu.
Proton i neutron posiadają niemal jednakową masę, około 1u. Proton ma ładunek dodatni, a neutron jest elektrycznie obojętny.
Liczba protonów w jądrze to liczba atomowa oznaczana symbolem Z, a liczba nukleonów (suma ilości protonów i neutronów) to liczba masowa A. Informacje o liczbie składników jądra możemy zapisać w postaci indeksów po lewej stronie symbolu chemicznego danego pierwiastka:

Grafika: Opis budowy atomu za pomocą symboli*. Źródło: Krzysztof Jaworski, OpenClips, dostępny w internecie: http://pixabay.com, licencja: CC BY-SA 3.0.
Liczba
atomowa Z jest równa liczbie protonów w jądrze, liczbie elektronów w atomie (dlatego
atom jest elektrycznie obojętny), i stanowi również liczbę porządkową w
układzie okresowym pierwiastków chemicznych.
W
przestrzeni wokół jądra zwanej chmurą elektronową znajdują się elektrony (promień elektronu jest rzędu 10-22 m). Masa elektronu jest rzędu 1/1823 u. Łączna masa wszystkich elektronów w atomie nie przekracza 0.1% masy atomu. Ładunek elektronu w atomie (i w innych
drobinach) nie jest zlokalizowany, lecz rozproszony nierównomiernie. Miarą tego rozproszenia
jest tzw. gęstość elektronowa czyli stosunek ładunku znajdującego się w
określonej objętości do tej objętości. Największa gęstość elektronowa jest tuż
przy jądrze i maleje wykładniczo z odległością od jądra atomowego, a w
odległości stu-kilkudziesięciu pm staje się zaniedbywanie mała, jednak
niezerowa. Nie można określić toru po jakim porusza się elektron, wiadomo
jedynie, że niektóre elektrony poruszają się bliżej jądra, a inne dalej.
Ujemny ładunek elektronu i dodatni ładunek protonu mają tę samą wartość bezwzględną (różnią się tylko znakami), zatem wartość ładunku elektronu została przyjęta za -1, a protonu za +1.
| Jądro atomowe | Chmura elektronowa | |
|---|---|---|
| Przybliżone rozmiary | 10-14 m | 10-10 m |
| Ładunek | dodatni | ujemny |
Elementy składowe Cząstki subatomowe |
protony (ładunek dodatni) i neutrony (elektrycznie neutralne) |
elektrony (ładunek ujemny) |
| Przybliżona masa pojedynczej cząstki | 1.7·10-27 kg (około 1800 razy masa elektronu) proton – masa 1,007276470 u neutron – masa 1,008664904 u |
9·10-31 kg elektron – masa 1/1823 u = 0,0005485799 u |
| Relatywna liczba cząstek | w większości jąder nieco większa liczba neutronów niż protonów | liczba elektronów jest równa liczbie atomowej Z, równa liczbie protonów |
Przybliżona gęstość materii [kg·dm-3 = g·cm-3] |
1012 kg·dm-3 |
1 kg·dm-3 |
Między jądrem i elektronami działają siły przyciągania elektrostatycznego. Z kolei elektrony odpychają się jak wszystkie ładunki jednoimienne. Również między protonami działają siły odpychania elektrostatycznego. Jądro utrzymują w całości inne, znacznie większe siły przyciągające, zwane siłami jądrowymi lub oddziaływaniami silnymi. W wyniku działania wielu różnych sił atom jest trwały, a elektrony nie spadają na jądro ani się od niego nie oddalają.
Jądro atomowe determinuje właściwości fizyczne pierwiastka, natomiast struktura elektronowa decyduje o właściwościach chemicznych i niektórych właściwościach fizycznych.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
2. Izotopy
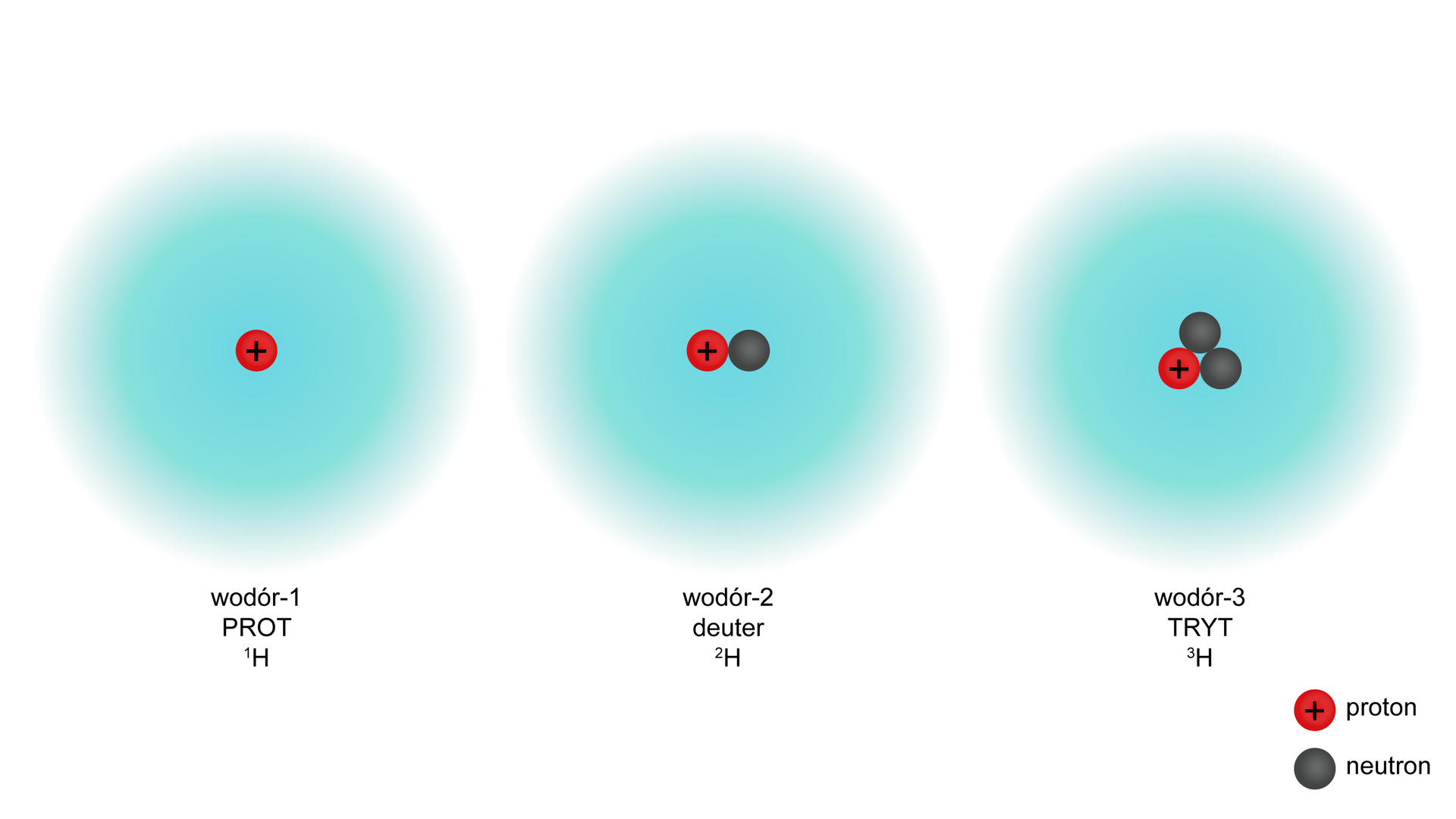
W odróżnieniu od liczby protonów, która jest cechą charakterystyczną dla wszystkich atomów danego pierwiastka i identyfikuje pierwiastek, liczba neutronów może być różna. Odmiany tego samego pierwiastka chemicznego o różnej liczbie neutronów, a zarazem różnej liczbie masowej, są nazywane izotopami. Atomy poszczególnych izotopów to nuklidy. W przypadków izotopów danego pierwiastka mają one takie same właściwości chemiczne (wyjątek stanowią izotopy wodoru), różnią się jednak nieznacznie właściwościami fizycznymi.
Grafika: Modele izotopów wodoru*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Nazwę izotopu tworzy
się przez dodanie do nazwy pierwiastka informacji o liczbie masowej, np.:
miedź-63, miedź-65; podobnie wystarczy, że symbol izotopu będzie zawierał
liczbę masową, a jednoznacznie określi to dany izotop, 63Cu, 65Cu.
Grafika: Skład izotopowy miedzi*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Pierwiastki cechują
bardzo różne ilości izotopów; niektóre istnieją w przyrodzie jako tzw. pierwiastki
czyste izotopowo, czyli w postaci tylko jednego trwałego nuklidu danego
pierwiastka. Pierwiastków nieizotopowych jest 22, są wśród nich: fluor, sód , fosfor.
Jeśli chcesz poznać skład izotopowy poszczególnych pierwiastków chemicznych odwiedź stronę „IUPAC Periodic Table of the Elements and Isotopes”.
Przeważająca większość pierwiastków ma 2 izotopy lub więcej. Największa liczba trwałych izotopów charakteryzuje cynę, wyodrębniono 10 nuklidów tego pierwiastka.
W przypadku gdy pierwiastek chemiczny jest mieszaniną izotopów jego masa atomowa jest średnią ważoną z mas atomowych jego poszczególnych izotopów. Średnia ta uwzględnia zawartości procentowe izotopów w naturalnej, występującej w przyrodzie, mieszaninie.

mat – masa atomowa pierwiastka,
m1, m2, ... – masy poszczególnych izotopów,
p1, p2, ... – procentowe zawartości izotopów.
Procentowy udział każdego izotopu w zbiorze atomów danego pierwiastka pozostaje niezmienny, a zawartość procentowa poszczególnych izotopów jest niezależna od rodzaju minerału, z którego uzyskano dany pierwiastek i od geograficznego położenia i wieku złóż tego minerału.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot
3. Jądro atomowe
Energia wiązania nukleonów w jądrze
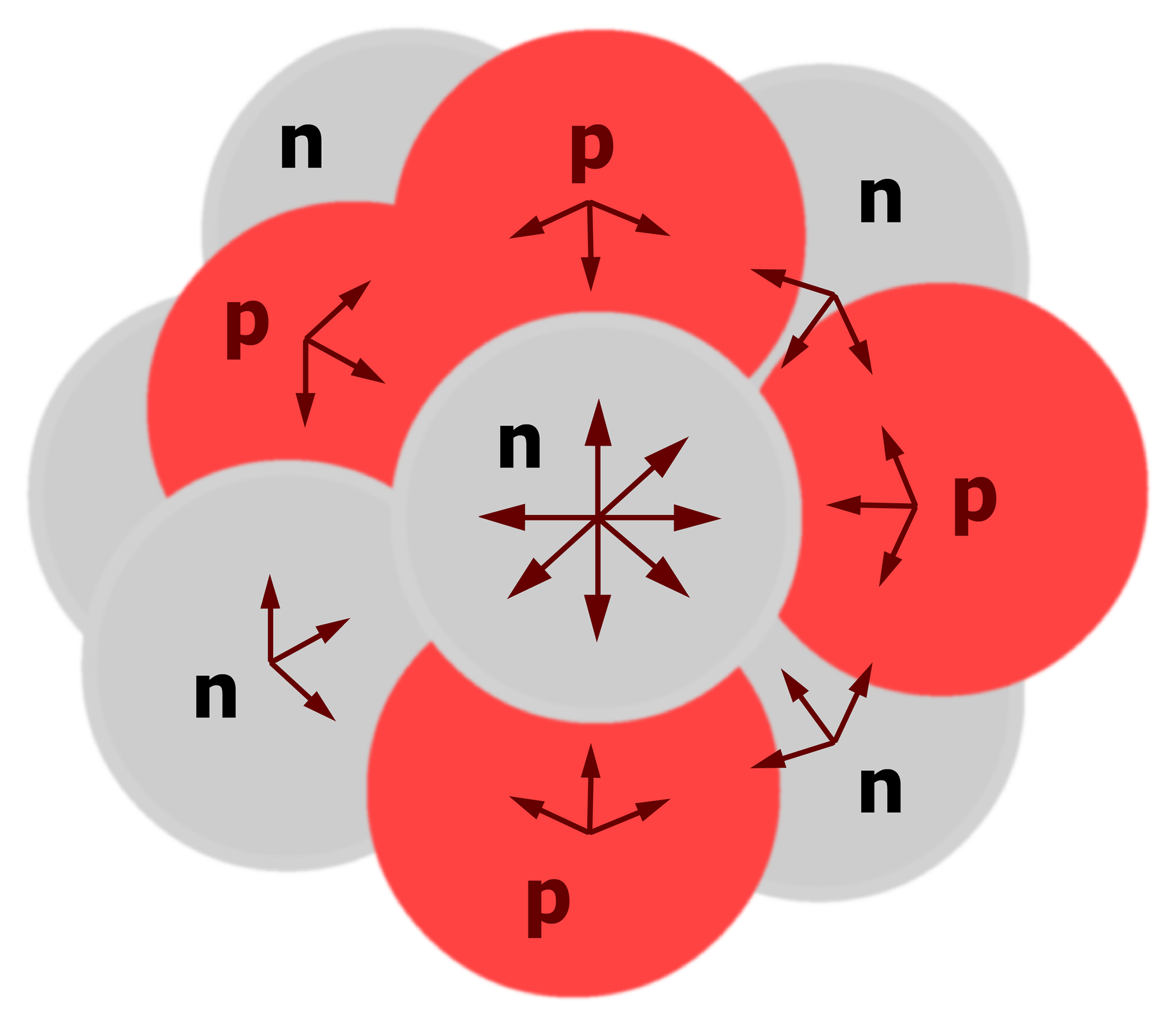
Grafika: Siły przyciągania pomiędzy nukleonami*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Siły elektrostatycznego odpychania między protonami znajdującymi się w małych odległościach od siebie są znaczne, mimo to większość jąder stanowi układy bardzo trwałe. Wynika to z istnienia sił jądrowych, którym podlegają wszystkie nukleony niezależnie od ich ładunku elektrycznego.
Cechą charakterystyczną sił jądrowych jest to, że bardzo szybko zanikają w miarę wzrostu odległości, a duże wartości przyjmują tylko wtedy, gdy nukleony znajdują się w odległościach nie przekraczających rozmiarów jąder. Są to zatem siły krótko-zasięgowe.
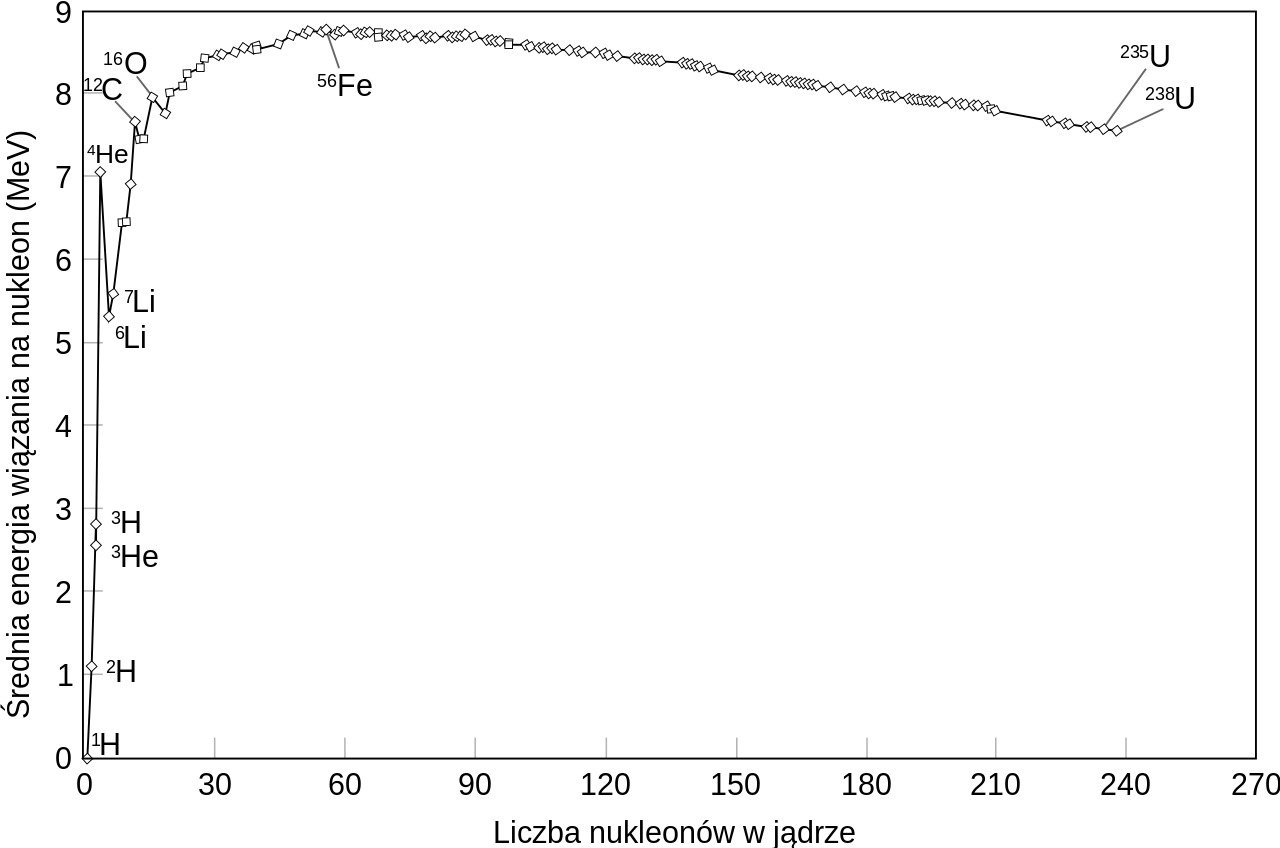
Energia wiązania jądra jest przedstawiana w odniesieniu do energii wiązania jednego nukleonu w jadrze (energia separacji nukleonu). Energia wiązania nukleonu dla większości nuklidów jest rzędu 7-8,7 MeV. Maksymalną wartość osiąga dla jąder o liczbie masowej 56.
Grafika: Energia wiązania na jeden nukleon w zależności od liczby nukleonów w jądrze. Źródło: Persino, Binding energy curve - common isotopes-pl.svg, licencja: CC BY 3.0.
Zatem jeśli dodamy do siebie masy poszczególnych neutronów i protonów występujących w jądrze atomowym w celu otrzymania masy tego jądra, to wynik będzie większy od rzeczywistej masy jądra jako układu. Ubytek masy, który obserwujemy wynika z przetworzenia masy w energię wiązania jądra i można go wyjaśnić za pomocą podanej przez A. Einsteina zależności między masą, a energią: E = mc2.
Warunki trwałości jąder atomowych
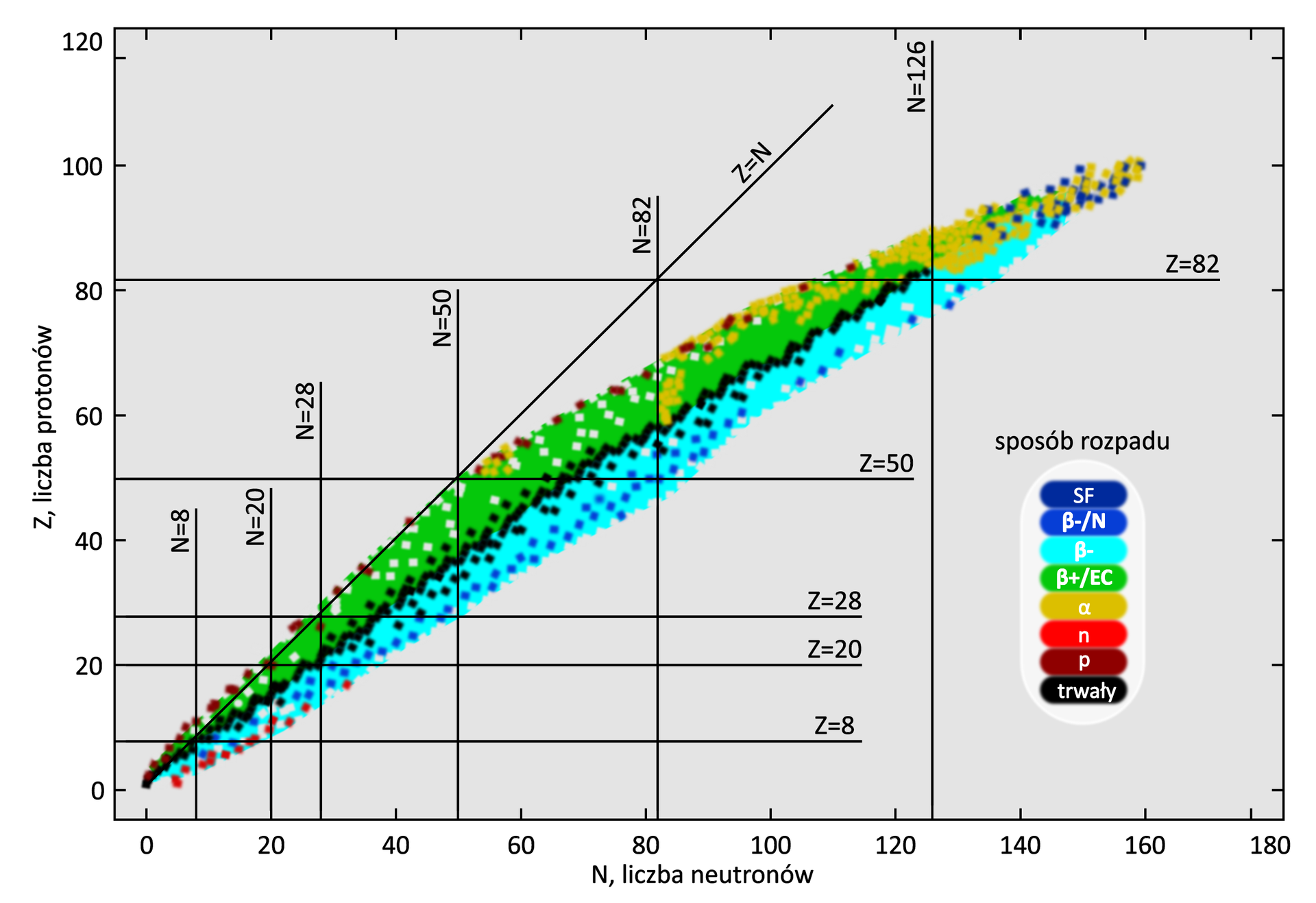
Grafika: Zależność liczby neutronów w jądrach izotopów, występujących w przyrodzie, od liczby atomowej pierwiastka*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Najtrwalsze są jądra atomowe o takiej samej liczbie protonów i neutronów, szczególnie wtedy gdy liczba ta jest parzysta. Sytuacje taką obserwujemy w jądrach o liczbach atomowych nie przekraczających 20 gdzie stosunek liczby neutronów do liczby protonów jest bliski jedności; w miarę zwiększania się liczby atomowej stosunek ten wzrasta do wartości ok. 1,6; i może się zmieniać dla izotopów danego pierwiastka tylko w wąskich granicach.
Chcesz wiedzieć więcej! Posłuchaj! "Dlaczego niektóre izotopy emitują promieniowanie?"
Audiobook: Dlaczego niektóre izotopy emitują promieniowanie?* Źródło: Agata Jarszak-Tyl, Patrycja Męcik, opracowano na podstawie: Cieśliński P., Majewski J., Śladami Marii Skłodowskiej-Curie, Warszawa 2011. Wielkie Biografie 3, Encyklopedia PWN, Warszawa 2008. Petelenz B., Pozytywizm, racjonalizm i ... romantyzm Marii Skłodowskiej-Curie, Zagadnienia Filozoficzne w Nauce, LIX, 2015. Michael F. L'Annunziata, Radioactivity: Introduction and History, Amsterdam, Netherlands 2007., licencja: CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
3.1. Przemiany jądrowe
Wyróżniamy dwie grupy przemian jądrowych: naturalne i
sztuczne. Podział przemian jądrowych przedstawia grafika poniżej:

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta – Chemia. Repetytorium dla przyszłych maturzystów i studentów – wydanie 2014].
Przemiany jądrowe podlegają zwanym w fizyce zasadami zachowania. Dwie z tych zasad znajdują odzwierciedlenie w równaniach przemian jądrowych:
1. Zasada zachowania liczby nukleonów – łączna liczba nukleonów w substratach jest równa łącznej liczbie nukleonów w produktach,
2. Zasada zachowania ładunku elektrycznego – sumaryczny ładunek wszystkich jąder i cząstek przed przemianą jest równy sumarycznemu ładunkowi wszystkich produktów przemiany.
Naturalne przemiany jądrowe zachodzą w przyrodzie samorzutne, bez
ingerencji człowieka. Ich przyczyną jest nietrwałość jąder, w których siły
elektrostatycznego odpychania protonów przewyższają siły wzajemnego
przyciągania wszystkich nukleonów, tzw. sił jądrowych. Nietrwałe
(promieniotwórcze) są jadra wszystkich pierwiastków, począwszy od bizmutu (Z=83)
do końca tablicy Mendelejewa, oraz jądra niektórych lżejszych pierwiastków, w
tym nielicznych występujących w przyrodzie (np. węgiel-14, potas-40), głównie
jednak wytworzonych sztucznie w taki sposób jak transuranowce.
Sztuczne przemiany jądrowe wywołuje człowiek.
3.2. Przemiany naturalne
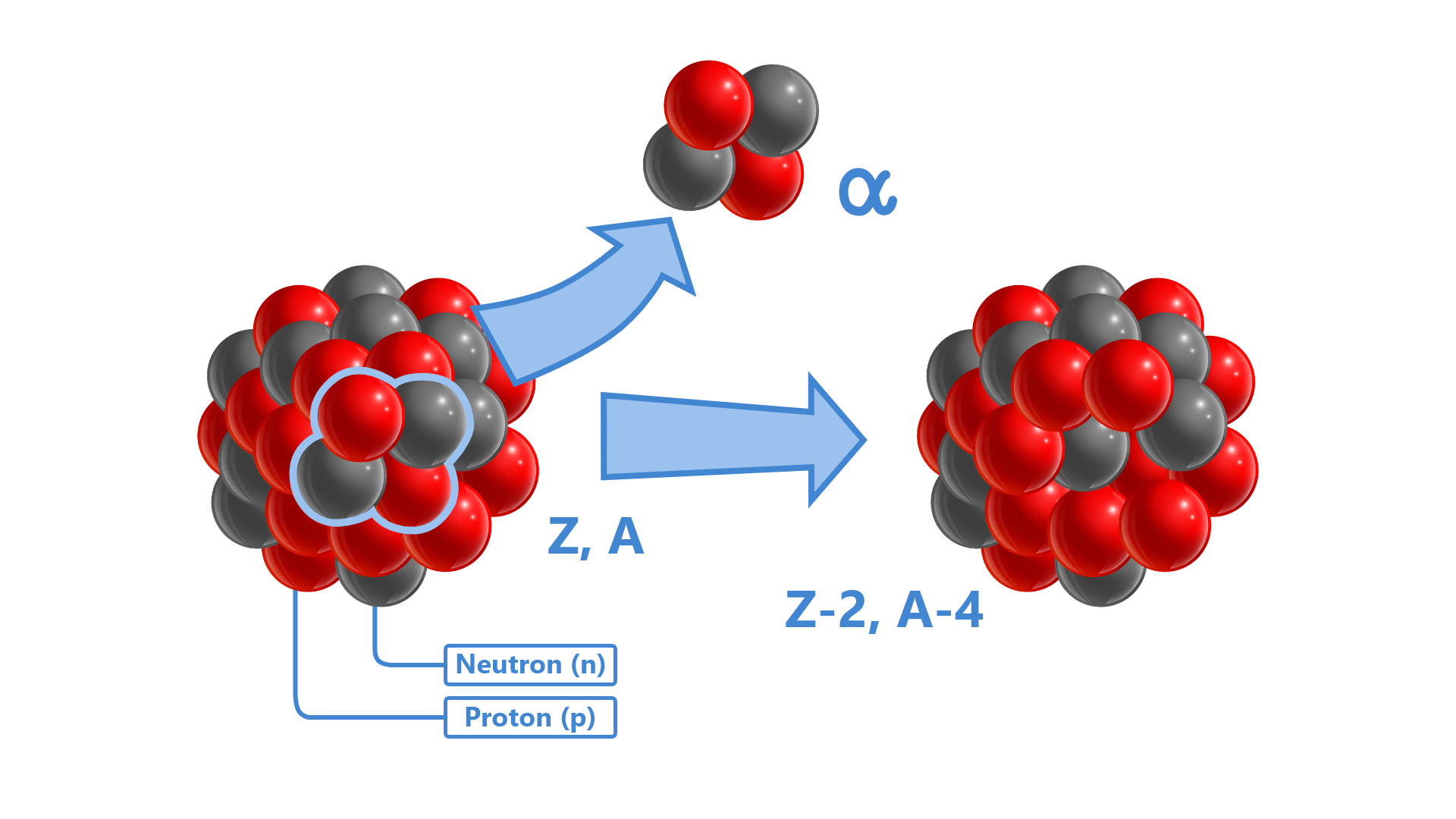
Rozpad α
polega na rozpadzie jądra na nowe jądro i cząstkę α.
Grafika: Emisja cząstki alfa przez jądro atomowe*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
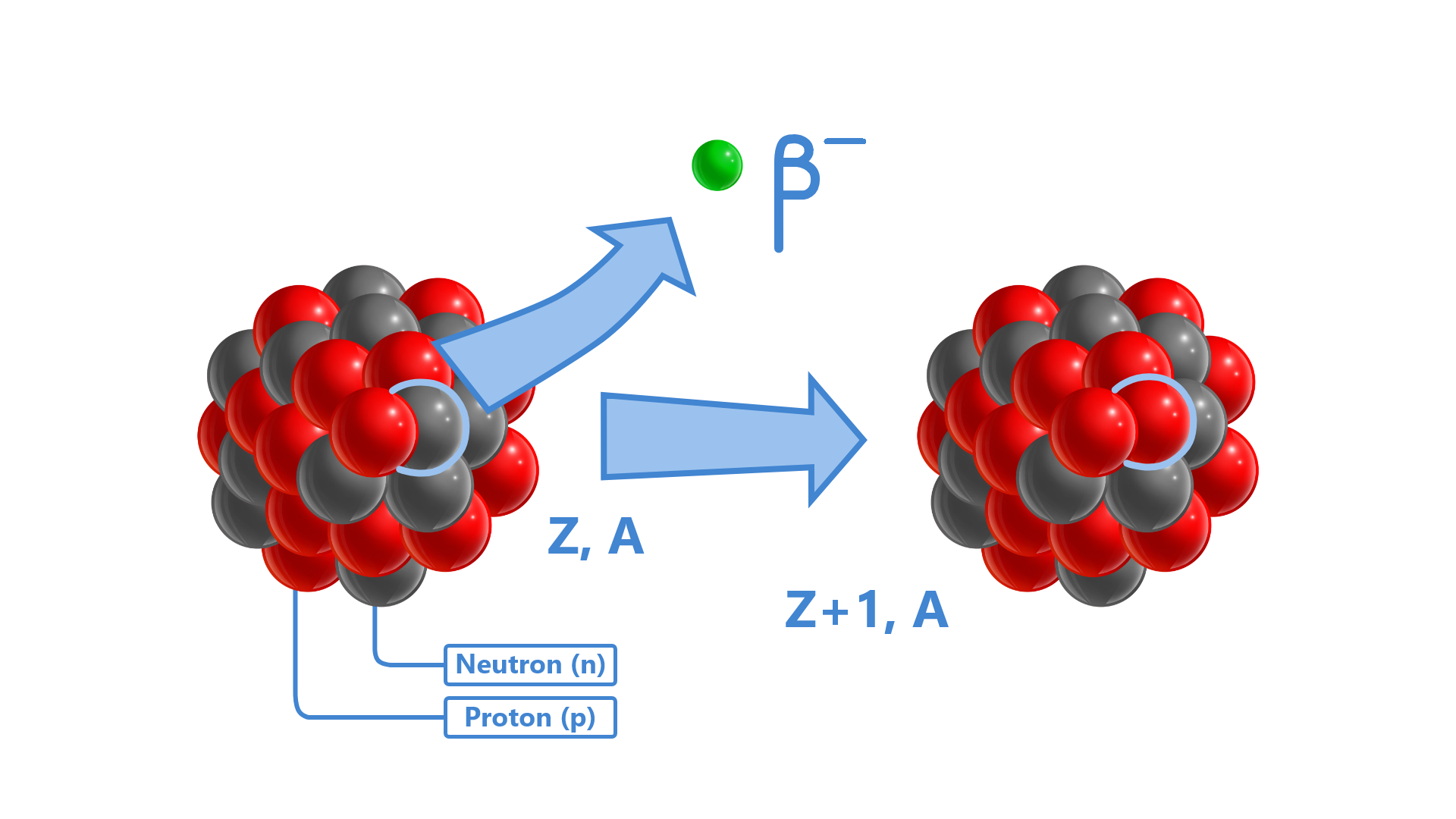
Rozpad β- polega na rozpadzie jądra na nowe jądro i cząstkę β-.
Grafika: Emisja cząstki beta minus przez jądro atomowe*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
Cząstka β- jest elektronem wytworzonym w jądrze na skutek przemiany:
![]()
Rozpad β+ polega na rozpadzie jądra na nowe jądro i pozyton.
Grafika: Emisja cząstki beta plus przez jądro atomowe*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
Pozyton (cząstka β+) jest dodatnim elektronem wytworzonym w jądrze na skutek przemiany:

Rozpadowi β+ ulegają izotopy promieniotwórcze wytworzone sztucznie.
Wychwyt elektronu (EC – electron capture) polega na pochłonięciu przez jadro jednego z elektronów wokółjądrowych, najczęściej z powłoki K (stąd nazwa wychwyt K), rzadziej z powłoki L (wychwyt L).
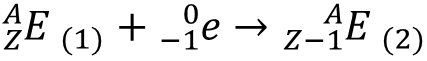
Przemiana ta jest konkurencyjna w stosunku do przemiany β+ i następuje, gdy w jej wyniku powstaje bardziej trwale jądro. Jeden z protonów jądra zamienia się w neutron:
![]()
Wychwytowi elektronu towarzyszy zawsze emisja promieniowania rentgenowskiego i często promieniowania γ.
Przemiany β-, β+, EC określa się wspólną nazwą przemian β.
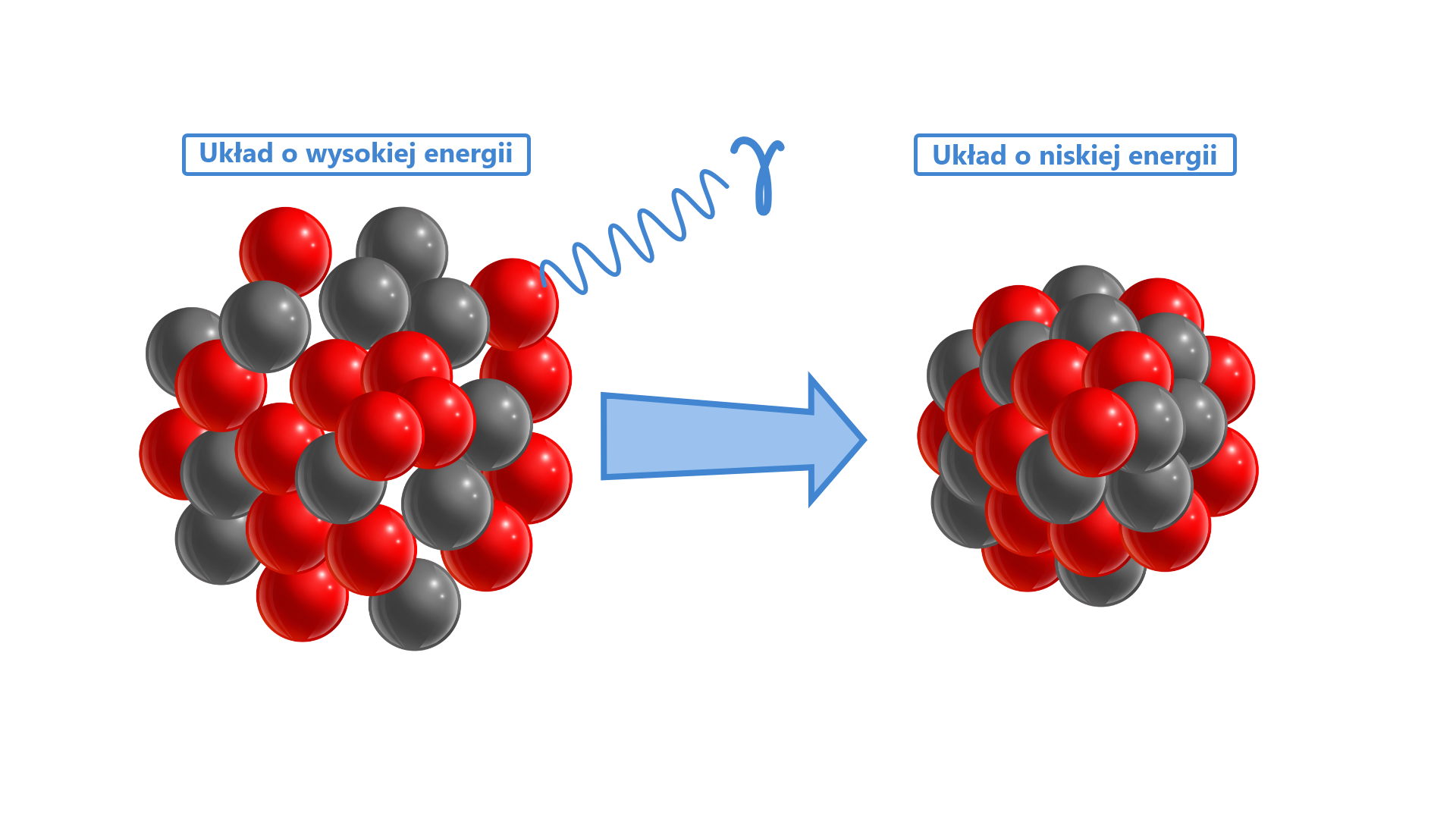
Przejście izomeryczne (PI lub IT – isomeric transition) polega na spontanicznej emisji kwantu γ bez zmiany składu jądra. Przejściu izomerycznemu ulegają izomery mniej trwałe tzw. metastabilne, oznaczane mała literą m obok liczby masowej nuklidu.
Grafika: Promieniowanie gamma i towarzysząca mu zmiana energii układu*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
Substrat i produkt różną się jedynie energią i są nazywane izomerami jądrowymi.
Rozszczepienie samorzutne (RS lub SF – spontaneous fission) polega na rozpadzie jądra na dwa fragmenty i kilka neutronów.
Dotychczas w przyrodzie zaobserwowano to zjawisko jedynie dla jąder uranu, przy czym rozpad może przebiegać różnie, ale zawsze powstające produkty stanowią pierwiastki położone w pobliżu środka tablicy Mendelejewa lub produkty są β-promieniotwórcze i dają szereg kolejnych pierwiastków.
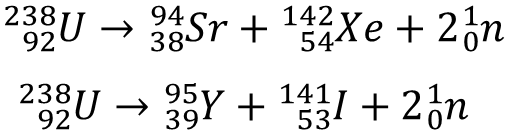
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot
3.3. Sztuczne przemiany jądrowe
Reakcja jądrowa polega
na zderzeniu cząstki lub niewielkiego jądra z innymi jądrami, w wyniku czego
powstaje nowe jądro, wyrzucając zwykle jedno lub kilka cząstek:
Grafika: Proste reakcje jądrowe - graficzny schemat reakcji*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
![]()
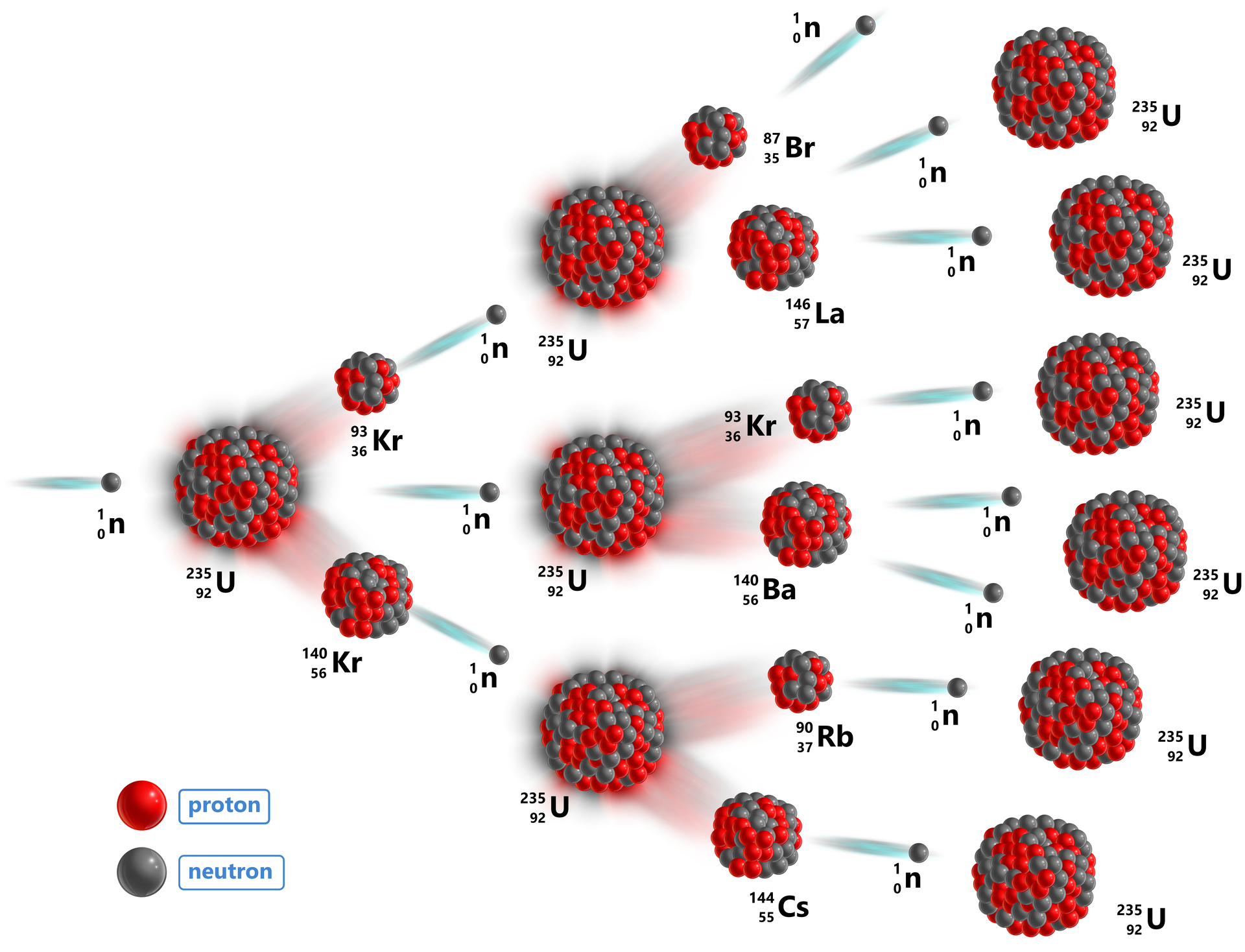
Rozszczepienie jądrowe przebiega w sposób następujący: cząstka uderzająca w ciężkie jądro powoduje jego rozpad na dwa jądra średniej wielkości z równoczesnym uwolnieniem kilku cząstek.
Przykładem jest rozszczepienie uranu-235 neutronem:
Grafika: Reakcja rozszczepienia uranu-235*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
![]()
Produktami rozszczepienia uranu‑235 może być około 300 izotopów 37 różnych pierwiastków. Najczęściej powstają jądra o liczbach masowych zbliżonych do 95 i 138. W wyniku rozszczepienia jądra uranu powstają również neutrony, które staja się pociskami inicjującymi dalsze rozszczepienie kolejnych jąder atomowych. Tego typu reakcję nazywamy reakcją łańcuchową.
Grafika: Reakcja łańcuchowa rozszczepienia uranu-235*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
Fuzja jądrowa polega na zderzeniu dwóch jąder lekkich i utworzeniu nowego jądra, najczęściej z wyrzuceniem cząstki i uwolnieniem olbrzymiej ilości energii.
Przykład:
Grafika: Reakcja powstawania atomów helu z izotopów wodoru: deuteru i trytu*. Źródło: GroMar Sp. z o.o., licencja: CC BY 3.0.
![]()
Fuzje jądrowe zachodzą we wnętrzu gwiazd,
w tym również w Słońcu.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot
3.4. Szybkość rozpadu promieniotwórczego i okres półtrwania
Szybkość rozpadu promieniotwórczego
Szybkość rozpadu wszystkich nietrwałych jąder, zarówno naturalnych jak i sztucznych, jest w każdej chwili wprost proporcjonalna do liczby jeszcze nie rozłożonych atomów N.
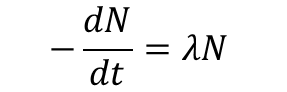
Szybkość tę wyrażamy stosunkiem liczby atomów dN do czasu dt, w którym atomy te ulegają rozpadowi.
- λ - stała rozpadu promieniotwórczego,
- znak minus kładziemy z uwagi na fakt, że dN jako liczba przedstawiająca ubytek liczby atomów jest liczbą ujemną, szybkość natomiast musi być wielkością dodatnią.
Okres półtrwania
Miarą szybkości rozpadu promieniotwórczego jest okres półtrwania (okres połowicznego zaniku), oznaczony symbolem T1/2. Jest to czas, w którym połowa początkowej liczby jąder ulega rozpadowi:
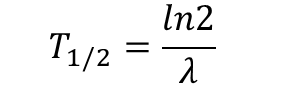
Okres półtrwania jest cechą danego radionuklidu i waha się od ułamków sekund do miliardów lat, jest niezależny od ilości początkowej danego radionuklidu, nie zależy od temperatury, ciśnienia i otoczenia chemicznego.
Ikona (źródło): Reshot
3.5. Szeregi promieniotwórcze
Szeregi promieniotwórcze to zespoły
powiązanych ze sobą radionuklidów, z
których każdy kolejny powstaje w wyniku rozpadu poprzedniego.
Każdy szereg promieniotwórczy rozpoczyna inny radionuklid, są to np.: uran-238, uran-235, tor-232; a kończy jeden z trwałych izotopów ołowiu, np.:ołów-206, ołów-207, ołów-208.
W poszczególnych szeregach promieniotwórczych zaobserwowano zjawisko tzw. . rozgałęzienia się szeregu, które polega na tym, że niektóre z radionuklidów są jednocześnie b-promieniotwórcze i a-promieniotwórcze. Należy zwrócić uwagę, że żaden radionuklid nie może być równocześnie członem dwóch szeregów promieniotwórczych.
W preparacie promieniotwórczym pozostawionym do ustalenia się stanu stacjonarnego obecne są wszystkie produkty rozpadu, a stosunek ich ilości równy jest stosunkowi ich okresów półtrwania.
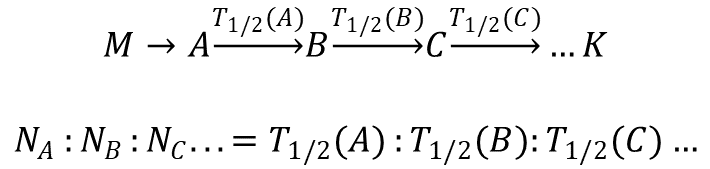
M – radionuklid macierzysty,
A, B, C… – człony szeregu w stanie równowagi promieniotwórczej,
T1/2() – okres półtrwania radionuklidu zapisanego w nawiasie,
N() – liczba atomów radionuklidu zapisanego w nawiasie,
K – radionuklid trwały kończący szereg.
Do wyjątków, nie objętych równowagą, należą radionuklidy rozpoczynające szeregi promieniotwórcze – powoli ich ubywa, oraz kończące szereg – wciąż ich przybywa. Na Ziemi znajdują się jeszcze znaczne ilości radionuklidów rozpoczynających poszczególne szeregi (uran-238, uran-235, tor-232), a ich okresy półtrwania są długie, porównywalne z wiekiem Ziemi.
Stan stacjonarny, w którym zachowane są stałe stosunki ilości współistniejących pierwiastków, nazywany jest stanem równowagi promieniotwórczej.
Zamiast liczby atomów N można podać masy lub liczność materii. Znając okresy półtrwania członów szeregu i ilość jednego z nich, można obliczyć ilości wszystkich pozostałych radionuklidów objętych równowagą.
Jeśli chcesz dowiedzieć się więcej zobacz symulacje interaktywna "Naturalne szeregi promieniotwórcze"._________________Grafika interaktywna: Naturalne szeregi promieniotwórcze* Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
* Wykorzystano materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
3.6. Zastosowania promieniotwórczości
Aby zapoznać się ze współczesnymi zastosowaniami promieniotwórczości oglądnij film "Zastosowania promieniotwórczości".
Film: Zastosowanie promieniotwórczości*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0._________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
3.7. Izotopowy zapis przeszłości Ziemi
Metody datowania:
Metoda rubidowo-strontowa (Rb-Sr) oparta na przemianie β- 87Rb w 87Sr, wykorzystywana do datowania bezwzględnego minerałów i skał magmowych i osadowych o wieku ponad 100 mln lat (czas połowicznego rozpadu izotopu rubidu wynosi około 48,6 mld lat, wobec tego tylko około 6% pierwotnego 87Rb uległo rozkładowi od czasu powstania Ziemi 4,5 miliarda lat temu). Metoda ta dostarcza również istotnych wskazówek petrogenetycznych w odniesieniu do skał magmowych i metamorficznych. Problem może stanowić fakt, że w trakcie procesów petrogenzy rubid i stront podążają scieżkami ewolucyjnymi naśladując potas i wapń.
Datowanie samarowo-neodymowe to radiometryczna metoda datowania przydatna do określania wieku skał i meteorytów, oparta na rozpadzie α izotopu samaru-147 do stabilnego radiogennego izotopu neodymu-143. Przydatność datowania Sm – Nd wynika z faktu, że te dwa pierwiastki należą do pierwiastków ziem rzadkich, o o bardzo bliskich cechach chemicznych i dlatego w znacznie mniejszym stopniu podlegaja zróżnicowaniu w trakcie procesów głębokich przeobrżeń materii skalnej.
W wielu przypadkach dane dotyczące izotopów Sm – Nd i Rb – Sr są używane razem.
Datowanie lutetowo-hafnowe to metoda datowania wykorzystująca system rozpadu promieniotwórczego lutetu-176 do hafnu-176. System Lu – Hf jest obecnie powszechnym narzędziem w badaniach petrogenetycznych skał magmowych i metamorficznych.
Metody renowo-platynowo-osmowe (Re-Pt-Os):
- Datowanie renowo-osmowe to datowanie radiometryczne oparte na rozpadzie β- izotopu 187Re do 187Os.
- Metoda platynowo-osmowa opiera się na promieniotwórczej przemianie α izotopu platyny-190 do osmu-186.
do 50 000 lat temu. Datowanie oblicza się mierząc stosunek ilości toru do uranu. Czas połowicznego rozpadu toru wynosi ok. 75 tys. lat.
3.8. Czy należy bać się promieniotwórczości?
Aby odpowiedzieć sobie na pytanie "Czy należy bać się promieniotwórczości?" oglądnij film.
Film: Czy należy bać się promieniotwórczości?*. Źródło: LEARNETIC SA, licencja: CC BY-SA 4.0._________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
3.9. Energetyka jądrowa
Jeśli chcesz dowiedzieć się czegoś więcej "O energetyce jądrowej" oglądnij film.
Film: O energetyce jądrowej*. Źródło: Politechnika Warszawska, Wydział Fizyki, licencja: CC BY-SA 3.0._________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
4. Bibliografia
Adam Bielański, Podstawy chemii nieorganicznej. Warszawa : Wydawnictwo Naukowe PWN, 2013.
Robert Gill, Chemical Fundamentals of Geology and Environmental Geoscience. Sussex : Wiley-Blackwell, 2015.
Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.
Jan Burchart, Ján Král', Izotopowy zapis przeszłości Ziemii, Lublin : Wydawnictwo Uniwersytetu Marii Curie-Skłodowskiej, 2015.
Dariusz Witowski, Jan S. Witowski, Chemia - zbiór zadań wraz z odpowiedziami - tom 1-4 (2002-2019) dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii. Łańcut : Oficyna Wydawnicza "Nowa Matura".
Ikona (źródło): Reshot