Co po co Geologowi wiedza o strukturze elektronowej atomu?
| Strona: | Open AGH - Otwarte Zasoby Edukacyjne |
| Kurs: | Elementy chemii nieorganicznej dla geologów |
| Książka: | Co po co Geologowi wiedza o strukturze elektronowej atomu? |
| Wydrukowane przez użytkownika: | Guest user |
| Data: | piątek, 30 stycznia 2026, 09:04 |
Spis treści
- 1. Elektronowa struktura atomu
- 1.1. Liczby kwantowe
- 1.2. Konfiguracja elektronowa
- 1.3. Powłoki elektronowe i konfiguracja powłokowa
- 1.4. Podpowłoki elektronowe i konfiguracja podpowłokowa
- 1.5. Stany orbitalne i konfiguracja orbitalna
- 1.6. Sekwencja energetyczna podpowłok
- 1.7. Bloki konfiguracyjne
- 1.8. Rdzeń atomowy i elektrony walencyjne
- 1.9. Konfiguracja elektronowa jonów jednojądrowych
- 1.10. Podsumowanie
- 2. Bibliografia
1. Elektronowa struktura atomu
Aby scharakteryzować stan elektronu w atomie, należy określić:
- Energii elektronu,
- Orbitalny moment pędu,
- Rzut momentu pędu na wyróżniony kierunek w przestrzeni (np. składowa z momentu pędu),
- Spin (spinowy moment pędu),
- Rzut spinu (spinowego momentu pędu) na wyróżniony kierunek.
Wielkości te przyjmują tylko pewne, ściśle określone wartości, które zależą od liczb kwantowych.
1.1. Liczby kwantowe
Oglądnij film omawiający "Jak opisać stan elektronu w atomie za pomocą liczb kwantowych?" , wprowadzi Cię on w zagadnienia poruszane w tym temacie.
Film: Jak opisać stan elektronu w atomie za pomocą liczb kwantowych?*. GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Główna liczba kwantowa n, przyjmuje wartości liczb naturalnych 1, 2, 3,… i charakteryzuje energię elektronu na danym poziomie energetycznym, czyli w danej powłoce elektronowej.
Wzrastającej wartości n odpowiada wzrastająca wartość energii elektronu:
Poboczna liczba kwantowa l, orbitalna liczba kwantowa, kwantuje orbitalny moment pędu elektronu; charakteryzuje kształt orbitali.
W atomach wieloelektronowych od wartości tej liczby również zależy energia elektronu.
Liczba ta przyjmuje wartości od 0 do n-1:

Często wartości tej liczby zastępuje się odpowiednimi symbolami literowymi oznaczającymi kolejne podpowłoki.

Graficzna reprezentacja orbitali
Orbital typu s ma kształt kuli. Orbital 2s jest większy od orbitalu 1s, a orbital 3s jest jeszcze większy niż orbital 1s oraz 2s. Przypomina to kolejne piłki tenisowe, jedną wewnątrz drugiej. Między kolejnymi kulami znajduje się powierzchnia węzłowa (węzeł), gdzie istnieje zerowe prawdopodobieństwo znalezienia elektronu.

Grafika: Orbitale typu s*. Źródło: ja:User:Azu, licencja: CC BY-SA 3.0.
Orbitale typu p są podobne do „ósemek” albo „klepsydry”. W przypadku orbitali typu p mówimy, że są trójkrotnie zdegenerowane, ponieważ istnieją trzy możliwe orbitale p, położone względem siebie prostopadle, wzdłuż osi x, y i z. Nazywane są odpowiednio px, py i pz.

Grafika: Orbitale typu p*. Źródło: ja:User:Azu, licencja: CC BY-SA 3.0.
Orbitale typu d są pięciokrotnie zdegenerowane, przyjmują skomplikowane nazwy i kształty, a ich reprezentacje graficzne przedstawiono poniżej:

Grafika: Orbitale typu d*. Źródło: ja:User:Azu, licencja: CC BY-SA 3.0.
Orbitalna magnetyczna liczba kwantowa m, kwantuje rzut momentu pędu na wyróżniony kierunek; określa w jaki sposób chmura elektronowa zachowuje się w polu magnetycznym.
Liczba ta przyjmuje wartości od -l do +l z zerem włącznie, przy czym liczba możliwych wartości tej liczby wyraża się wzorem 2l + 1.

Spinowa liczba kwantowa s, określa spinowy czyli własny moment pędu elektronu, który dla wszystkich elektronów przyjmuje tylko jedną wartość ½.
Ponieważ s jest zawsze równe +1/2 dla elektronu, nie jest konieczne uwzględnienie tej wartości w zbiorze liczb kwantowych opisujących stan każdego elektronu w atomie.
Magnetyczna spinowa liczba kwantowa ms, to rzut spinu (spinowego momentu pędu) na wyróżniony kierunek, który dla elektronów przyjmuje dwie wartości -½ i +½ - upraszczając, liczba ta określa kierunek obrotu elektronu wokół własnej osi w zewnętrznym polu magnetycznym.
_________________* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
1.2. Konfiguracja elektronowa
Mając na uwadze, iż dla elektronu kwantowaniu podlegają jego energia, orbitalny moment pędu, rzut momentu pędu na wyróżniony kierunek w przestrzeni (np. składowa z momentu pędu), spin (spinowy moment pędu), oraz rzut spinu (spinowego momentu pędu) na wyróżniony kierunek; związane z korpuskularnymi właściwościami elektronu, w zależności od wartości parametrów podlegających kwantowaniu, wprowadzono trójstopniową klasyfikację stanów stacjonarnych elektronów na: powłoki, podpowłoki i stany orbitalne. Przy czym stan stacjonarny danego mikroobiektu (na przykład elektronu czy jądra) jest definiowany jako stan, w którym wielkości skwantowane zachowują określoną wartość.
Rozmieszczenie elektronów na powłokach, podpowłokach i stanach orbitalnych to konfiguracja elektronowa. Zatem do opisu elektronów w atomie wykorzystuje się konfigurację powłokową, podpowłokową i orbitalną, zasadniczo różniące się liczbą zawartych w nich informacji.
I tak:
- konfiguracja powłokowa wskazuje na rozmieszczenie elektronów w powłokach,
- konfiguracja podpowłokowa wskazuje na rozmieszczenie elektronów na podpowłokach,
- konfiguracja orbitalna wskazuje rozmieszczenie elektronów w stanach (poziomach) orbitalnych.
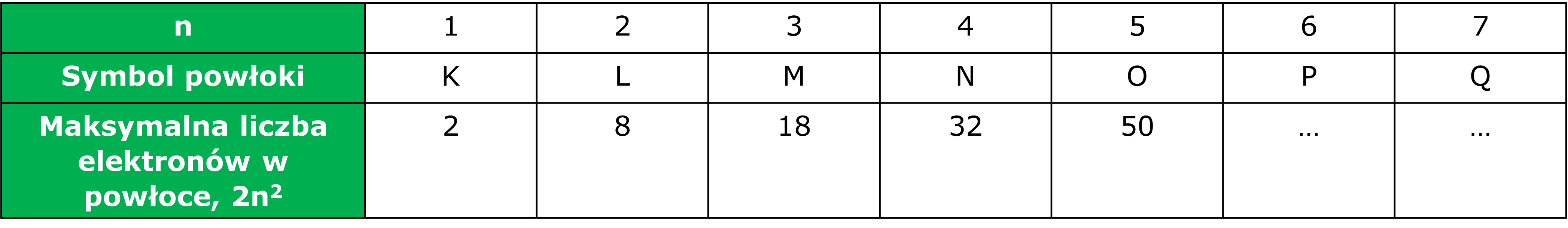
1.3. Powłoki elektronowe i konfiguracja powłokowa
Elektrony o zbliżonych wartościach energii tworzą powłokę elektronową. Elektrony należące
do danej powłoki znajdują się w przestrzeni (warstwie) zawartej między dwiema
sferami o wspólnym środku, w obrębie której najczęściej się poruszają. Granice
pomiędzy poszczególnym powłokami nie są ostre, a zatem wzajemnie się one przenikają.
Liczba powłok elektronowych poznanych dotychczas pierwiastków nie przekracza siedmiu (siedem okresów w układzie okresowym). Numerację powłok elektronowych rozpoczyna się od powłoki najbliższej jadra, nadając im równocześnie odpowiednie symbole literowe.
Im więcej elektronów posiada dany atom tym więcej zapełniają one powłok. Przy czym powłoka elektronowa może być zajęta przez elektrony całkowicie, częściowo lub niezajęta. Im wyższy numer powłoki tym dalej od jądra znajduje się odpowiadająca mu warstwa i tym słabsze są siły wiążące elektrony z jądrem.
Maksymalna liczba elektronów w powłoce jest określana iloczynem 2n2, w którym n oznacza numer powłoki (równy głównej liczbie kwantowej), zatem powłoka pierwsza może zawierać 2 elektrony, powłoka druga – 8, itd.
Konfiguracja powłokowa to rozmieszczenie elektronów w powłokach. Zapisywana z wykorzystaniem literowych symboli powłok zajętych przez elektrony i liczby elektronów w poszczególnych powłokach podawanej z prawej strony danego symbolu powłoki w indeksie górnym.
Przykład:
20Ca: K2L8M8N2
Konfiguracja powłokowa jest łatwa do ustalenia tylko w przypadku pierwiastków grup głównych. W przypadku pierwiastków grup poboczny oraz lantanowców i aktynowców algorytm opisany poniżej nie może być stosowany.
Etapy ustalania konfiguracje powłokowej dla pierwiastków grup głównych:
- Ustalić liczbę obsadzanych powłok elektronowych (równa numerowi okresu, w którym leży dany pierwiastek),
- Wpisać liczbę elektronów dla ostatniej powłoki (równa liczbie jedności w numerze grupy, w której leży dany pierwiastek),
- Dla powłok, poza przedostatnią, wpisać maksymalne liczby elektronów, wynikające ze wzoru 2n2,
- Liczbę elektronów w przedostatniej powłoce obliczyć odejmując od liczby atomowej liczbę elektronów obsadzoną już na pozostałych powłokach.
Jeżeli obliczona w ten sposób liczba elektronów w przedostatniej powłoce wyjdzie ujemna, co ma miejsce w przypadku Cs, Ba, Fr, Ra, to należy przyjąć dla niej osiem elektronów, a liczbę elektronów na powłoce trzeciej od końca obliczyć, odejmując od liczby atomowej liczbę elektronów na pozostałych powłokach.
Przykład:
55Cs: K2L8M18N32O-11P1 → 55Cs: K2L8M18N?O8P1 → 55Cs: K2L8M18N18O8P1
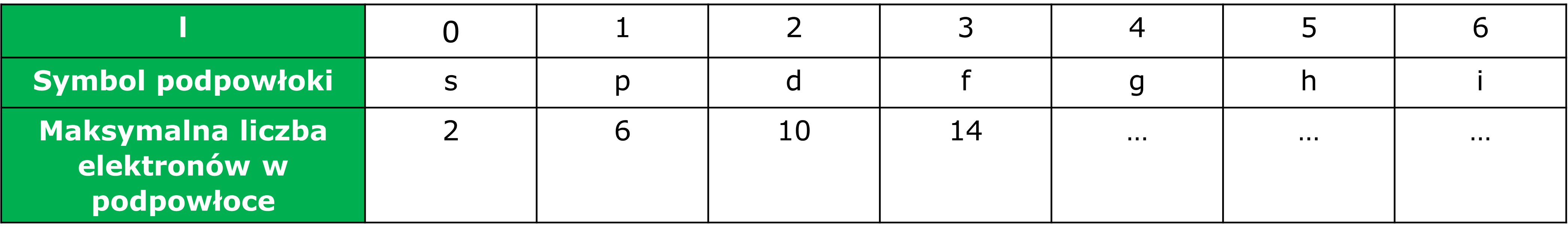
1.4. Podpowłoki elektronowe i konfiguracja podpowłokowa
Ze względu na fakt, iż elektrony tworzące powłokę mają energię zbliżoną, ale nie taką samą, można je w obrębie powłoki podzielić na mniejsze zespoły o równej energii, nazywane podpowłokami elektronowymi.
Podpowłoki podobnie jak powłoki mają swoje oznaczenia literowe s, p, d, f (dalej g, h, …), a należące do nich elektrony nazywa się odpowiednio elektronami s, p itd. Charakteryzuje je również ograniczona i stała pojemność: podpowłoka s może zawierać najwyżej 2 elektrony, a każda następna podpowłoka (p, d, f…) ma pojemność o 4 elektrony większą od poprzedniczki, stad p – 6, d – 10, f – 14 elektronów.
Wraz ze wzrostem numeru powłoki wzrasta liczba możliwych podpowłok i jest ona równa numerowi powłoki, zatem powłoka pierwsza posiada tylko jedną podpowłokę (1s), co wskazuję, że praktycznie powłoka ta nie dzieli się na podpowłoki, powłoka druga ma dwie podpowłoki (2s i 2p), trzecia – trzy (3s, 3p i 3d), a czwarta - cztery (4s, 4p, 4d, 4f), itd.
W obrębie danej powłoki energia elektronów zawsze wzrasta w kolejności s, p, d, f, …, wskazując na schemat zapełniania podpowłok. Również w tej samej kolejności wzrasta odległość między jądrem, a warstwą kulistą, w której elektrony danej podpowłoki przebywają najczęściej, natomiast maleje siła oddziaływania jądra i otaczających go elektronów.
Konfiguracja podpowłokowa to takie rozmieszczenie elektronów w powłokach i
podpowłokach, które zapewnia możliwie najniższą energię każdemu z nich
Umowny zapis podpowłokowej konfiguracji elektronowej zawiera ciąg symboli typu nak, gdzie n – numer powłoki (1-7), a – symbol podpowłoki (s, p, d, f, …), k – liczba elektronów w podpowłoce
Przykład:
20Ca: 1s22s22p63s23p64s2
|
Powłokowa konfiguracja elektronowa 20Ca |
K2 |
L8 |
M8 |
N2 |
|
Podpowłokowa konfiguracja elektronowa 20Ca |
1s2 |
2s22p6 |
3s23p6 |
4s2 |
Na podstawie zamieszczonego przykładu widać, iż część elektronów znajduje się w powłoce wyższej (czwartej), mimo iż nie została w pełni wykorzystana powłoka niższa (trzecia). Oznacza to że w podpowłoce 4s elektrony mają niższą energię niż miałyby w przypadku zajęcia podpowłoki 3d.
Konfiguracja podpowłokową można ustalić na podstawie znanej konfiguracji powłokowej, co zostało przedstawione w poniższym przykładzie:
55Cs: K2L8M18N18O8P1 → 55Cs: 1s22s22p63s23p64s23d104p65s24d105p66s1
Konfiguracja podpowłokową można również zapisać w postaci skróconej, z
wykorzystaniem ujętego w nawias kwadratowy symbolu helowca poprzedzającego dany
pierwiastek w układzie okresowym, oraz członów typu nak dla elektronów, które należy dodać do
tego helowca, aby uzyskać konfigurację atomu danego pierwiastka
Przykład:
55Cs: 1s22s22p63s23p64s23d104p65s24d105p66s1
55Cs: [Xe]6s1
1.5. Stany orbitalne i konfiguracja orbitalna
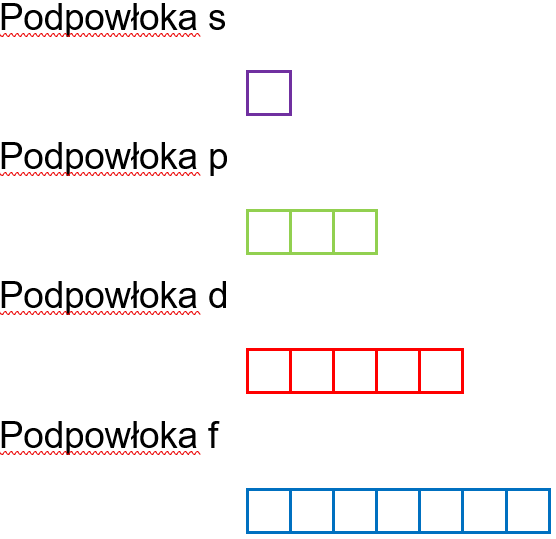
Elektrony danej podpowłoki ze względu na swoje zróżnicowanie pod względem posiadanych właściwości magnetycznych tworzą podzbiory zwane stanami orbitalnymi (poziomami orbitalnymi).
Wielkością fizyczną charakteryzującą pole magnetyczne wytworzone przez elektron jest spin. Spin elektronu ma jedną wartość i stanowi cechę charakterystyczną cząstki, dwa elektrony mogą się natomiast różnić orientacją spinu. Elektrony o przeciwnie zorientowanych spinach przyciągają się wzajemnie, a o jednakowej orientacji spinu – odpychają. Stąd każdy stan orbitalny może być zajęty najwyżej przez dwa elektrony różniące się orientacją spinu, przez co liczba stanów orbitalnych w podpowłoce jest równa połowie maksymalnej liczby elektronów jaką może być obsadzona podpowłoka.
Konfiguracja orbitalna to rozmieszczenie elektronów w stanach orbitalnych. Przedstawia się ją za pomocą umownych znaków graficznych. Liczba stanów orbitalnych dla poszczególnych podpowłok przedstawia się następująco: s – 1 stan orbitalny, p – 3 stany orbitalne, d – 5 stanów orbitalnych, f – 7 stanów orbitalnych, i jest ona charakterystyczna dla danej podpowłoki bez względu na numer powłoki do której należy.
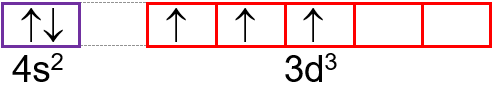
W zapisie konfiguracji orbitalnej elektron zaznaczany jest pojedynczą strzałką, skierowaną w górę (↑) lub w dół (↓), symbolizującą elektron zajmujący dany stan. Przy czym przeciwne zwroty strzałek (↑↓) oznaczają różne orientacje spinu, zgodne zwroty (↑↑) lub (↓↓) – takie same orientacje. Dwa elektrony zajmujące ten sam stan orbitalny, a więc elektrony o takiej samej energii, a różniące się jedynie orientacją spinu są nazywane elektronami sparowanymi. W przypadku gdy dany stan orbitalny zajmuje tylko jeden elektron to jest on nazywany elektronem niesparowanym.
Rozmieszczenie elektronów w stanach orbitalnych danej podpowłoki określa reguła Hunda według której, liczba niesparowanych elektronów w danej podpowłoce powinna być możliwie największa, a pary elektronów (↑↓) tworzą się dopiero po zapełnieniu wszystkich stanów orbitalnych danej podpowłoki przez elektrony niesparowane, natomiast elektrony zajmujące pojedynczo stany orbitalne w tej samej podpowłoce to elektrony o spinach równoległych (czyli elektrony o jednakowej orientacji spinu).
Przykład:
20Ca: 1s22s22p63s23p64s2

W praktyce zapis graficzny ogranicza się do tych podpowłok, które zapełnione są częściowo, a dla pozostałych należy podać konfiguracje podpowłokową.
Przykład:
23V: 1s22s22p63s23p64s23d3

23V: 1s22s22p63s23p6
1.6. Sekwencja energetyczna podpowłok
Sekwencja energetyczna podpowłok decyduje o kolejności ich zajmowania przez nowo przybywające elektrony. Poniższy schemat przedstawia kolejność obsadzania podpowłok przez elektrony:

Grafika: Schemat przedstawia kolejność obsadzania podpowłok przez elektrony*. Źródło: GroMar Sp. z o.o. opracowano na podstawie pl.wikipedia.org, licencja: CC BY-SA 3.0.
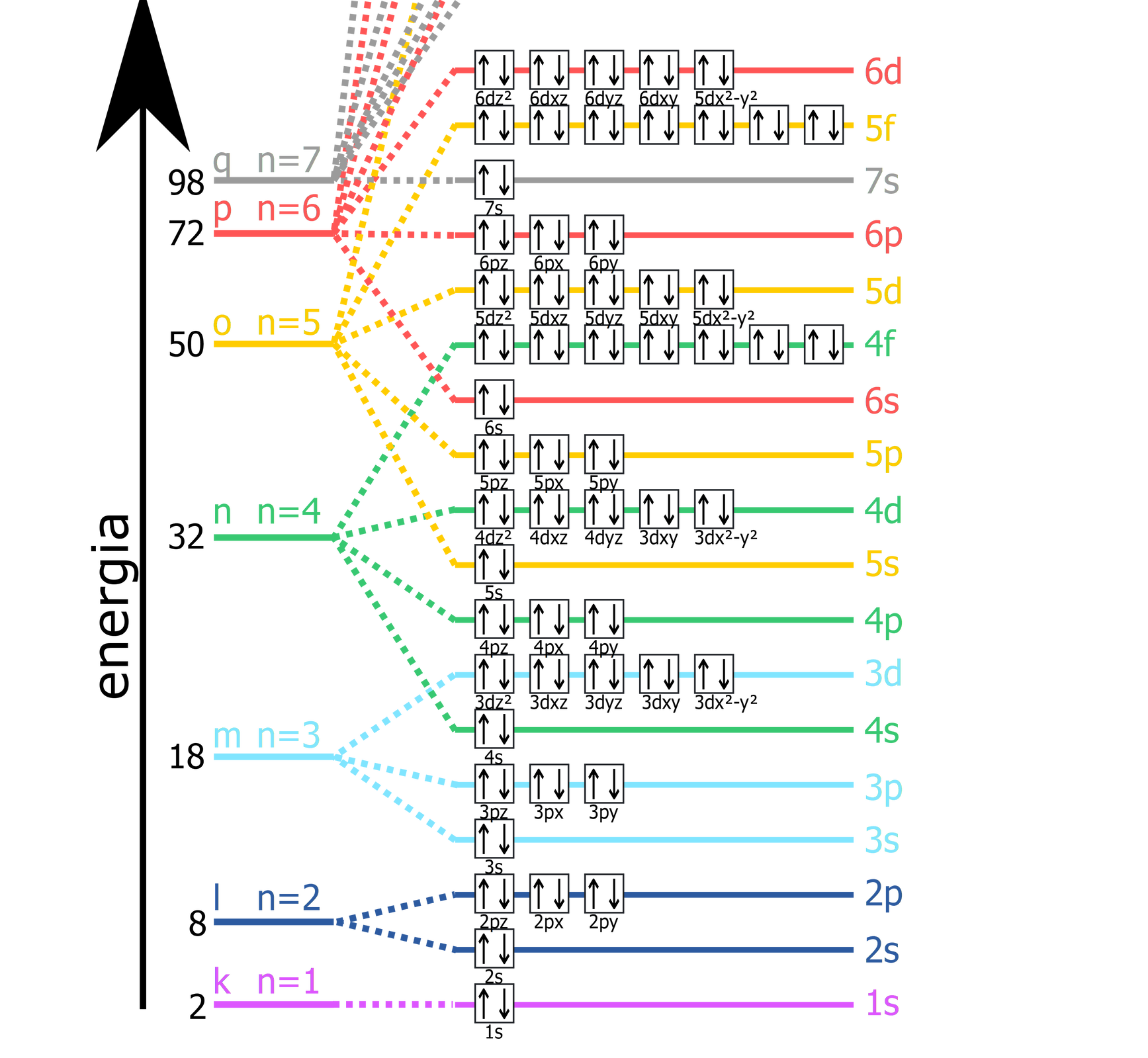
Grafika: Diagram energii orbitali atomowych*. Źródło: domena publiczna, dostępny w internecie: wikipedia.org.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
1.7. Bloki konfiguracyjne
Tablica Mendelejewa poza podziałem na grupy i okresy przedstawia również podział na cztery zespoły pierwiastków zwane blokami konfiguracyjnymi:
- blok s – zawiera pierwiastki s-elektronowe, a nowo przybywające elektrony zajmują podpowłokę ns,
- blok p – zawiera pierwiastki p-elektronowe, a nowo przybywające elektrony zajmują podpowłokę np,
- blok d – zawiera pierwiastki d-elektronowe, a nowo przybywające elektrony zajmują podpowłokę (n-1)d,
- blok f – zawiera pierwiastki f-elektronowe, a nowo przybywające elektrony zajmują podpowłokę (n-2)f.
gdzie n – numer okresu do którego należy dany pierwiastek.

Grafika: Bloki energetyczne układu okresowego*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
W przypadku bloków d i f zdarzają się nieliczne odstępstwa od obowiązujących reguł zapełniania podpowłok elektronowych spowodowane promocją elektronową.
Promocje elektronowe to zmiany konfiguracji elektronowej towarzyszące zwiększeniu liczby elektronów w atomach kolejnych pierwiastków układu okresowego, polegające na przejściu elektronu z podpowłoki ns na podpowłokę (n-1)d, albo odwrotnie, w atomach niektórych pierwiastków bloku d, lub z podpowłoki (n-1)d na (n-2)f, albo odwrotnie, w atomach niektórych pierwiastków bloku f.
Przyczyną promocji elektronowej są zmiany energii wszystkich elektronów towarzyszące wprowadzeniu kolejnego elektronu, które czasem powodują zmianę kolejności energetycznej podpowłok i w konsekwencji zmianę konfiguracji. Stwierdzono, że często układy d5 i d10 są korzystne energetycznie i preferowane.
Jednym z przykładów promocji elektronowej jest zmiana konfiguracji atom miedzi. Analizując konfigurację poprzedzającego go atomu niklu 28Ni: [Ar]4s23d8 należałoby oczekiwać, że nastąpi zwiększenie liczby elektronów d o jeden. Ze względu jednak na promocję elektronową jeden z elektronów podpowłoki 4s przechodzi do podpowłoki 3d całkowicie ją zapełniając:29Cu: [Ar] 4s23d9 → 29Cu: [Ar] 3d104s1
Na podstawie zwykłego układu okresowego pierwiastków chemicznych, nie zawierającego konfiguracji, nie da się ustalić, w których atomach występują promocje.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
1.8. Rdzeń atomowy i elektrony walencyjne
W względu na zachowanie atomów w reakcja chemicznych, można w ich obrębie wyróżnić dwie części: rdzeń atomowy i elektrony walencyjne.
Elektrony walencyjne – to elektrony, które podczas reakcji chemicznych biorą udział w tworzeniu wiązań chemicznych. Są zlokalizowane w zewnętrznej części atomu, przez co są stosunkowo słabo związane z jądrem i mogą być łatwo odrywane przez zbliżające się atomy.
Do elektronów walencyjnych należą:
- w atomach pierwiastków grup głównych układu okresowego wszystkie elektrony powłoki zewnętrznej; w atomach pierwiastków bloku s - są to elektrony ns, a w atomach pierwiastków bloku p – są to elektrony ns i np. Liczba elektronów walencyjnych jest w tym przypadku równa cyfrze jedności w numerze grupy.
11Na: 1s22s22p63s1
16S: 1s22s22p63s23p4
- w atomach pierwiastków grup pobocznych wszystkie elektrony powłoki zewnętrznej i
niektóre elektrony z powłoki drugiej od zewnątrz, a czasem nawet trzeciej od zewnątrz:
- w atomach pierwiastków bloku d elektrony ns oraz (n-1)d – liczba elektronów walencyjnych w tym przypadku jest równa numerowi grupy
23V: 1s22s22p63s23p64s23d3
47Ag: 1s22s22p63s23p64s23d104p65s14d10
- w atomach pierwiastków bloku f elektrony ns, (n-1)d, (n-2)f, czyli wszystkie elektrony powłoki zewnętrznej, elektrony d powłoki drugiej od zewnętrz oraz elektrony f powłoki trzeciej od zewnątrz
64Gd: 1s22s22p63s23p64s23d104p65s24d105p66s24f75d1
92U: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f35d1
Fragment konfiguracji elektronowej opisujący elektrony walencyjne jest nazywany konfiguracją walencyjną.
Rdzeń atomowy – stanowią pozostałe elektrony (niewalencyjne) wraz z jądrem. Jest to taka część atomu, która w czasie reakcji chemicznych zachowuje liczbę i rodzaj składników.
1.9. Konfiguracja elektronowa jonów jednojądrowych
Konfiguracja elektronowa kationów jest ustalana przez usuwanie kolejnych elektronów walencyjnych z macierzystego atomu w kolejności najpierw z podpowloki np, potem ns i dalej (n-1)d, (n-2)f.
Znacznie prostsze jest ustalanie konfiguracji anionu. W tym przypadku należy dodawać elektrony dopóki nie zostanie zamknięta powłoka a przez to osiągnięta konfiguracja helowca kończącego okres w tablicy Mendelejewa.1.10. Podsumowanie
W ramach podsumowania wiadomości o atomie i strukturze elektronowej atomów i jonów obejrzyj filmy
Jak zapisujemy konfigurację elektronową atomów i jonów?,Konfiguracja elektronowa atomu wapnia i jonu wapnia w stanie podstawowym”,
Konfiguracja elektronowa atomu bromu i jonu bromu w stanie podstawowym”,
Konfiguracja elektronowa atomu miedzi i jonu miedzi w stanie podstawowym”.
Filmy: Barbara Rolka, GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
_________________
* Filmy są zamieszczone na Zintegrowanej Platformie Edukacyjnej.
2. Bibliografia
Adam Bielański, Podstawy chemii nieorganicznej. Warszawa : Wydawnictwo Naukowe PWN, 2013.
Robert Gill, Chemical Fundamentals of Geology and Environmental Geoscience. Sussex : Wiley-Blackwell, 2015.
Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.
Dariusz Witowski, Jan S. Witowski, Chemia - zbiór zadań wraz z odpowiedziami - tom 1-4 (2002-2019) dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii. Łańcut : Oficyna Wydawnicza "Nowa Matura".
Ikona (źródło): Reshot









