Układ okresowy pierwiastków chemicznych i prawo okresowości
| Strona: | Open AGH - Otwarte Zasoby Edukacyjne |
| Kurs: | Elementy chemii nieorganicznej dla geologów |
| Książka: | Układ okresowy pierwiastków chemicznych i prawo okresowości |
| Wydrukowane przez użytkownika: | Guest user |
| Data: | piątek, 30 stycznia 2026, 09:04 |
1. Słów kilka o historii układu okresowego pierwiastków chemicznych
Zanim układ okresowy pierwiastków chemicznych przybrał postać do jakiej jesteśmy obecnie przyzwyczajeni minęło wiele lat i wielu badaczy miało w tym swój udział. Chociaż nie bez przyczyny nazywa się go tablicą Mendelejewa. Zapoznaj się w krótką animacją, przedstawiającą Długą drogę do systematyki pierwiastków.
Film: Długa droga do systematyki pierwiastków*. Źródło: Marcin Sadomski, Kevin MacLeod (http://incompetech.com), Carl August Schwerdgeburth (https://commons.wikimedia.org), DALIBRI (https://commons.wikimedia.org), Serge Lachinov (https://commons.wikimedia.org), nn. (https://commons.wikimedia.org), Amitchell125 (https://commons.wikimedia.org), Dimitri Mendeleev (https://commons.wikimedia.org), Krzysztof Jaworski, Tomorrow Sp. z o.o., licencja: CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
2. Układ okresowy pierwiastków chemicznych
Układ okresowy pierwiastków to zestawienie pierwiastków chemicznych w postaci tabeli, uporządkowanych według ich rosnącej liczby atomowej, grupujące pierwiastki według ich cyklicznie powtarzających się podobieństw właściwości, zgodnie z prawem okresowości Dmitrija Mendelejewa
Wersja układu okresowego opublikowana przez Międzynarodową Unię Chemii Czystej i Stosowanej (International Union of Pure and Applied Chemistry - IUPAC) 28 listopada 2016 roku zawiera 118 pierwiastków o liczbach atomowych od 1 do 118.
Odkrycia pierwiastków o liczbach atomowych 113 (nihonium), 115 (moscovium), 117 (tennessine) i 118 (oganesson) zostały potwierdzone w grudniu 2015 roku, a oficjalnie nazwy tym pierwiastkom nadano w listopadzie następnego roku.
Współczesna wersja układu okresowego, publikowana cyklicznie przez IUPAC, definiuje też podział pierwiastków na grupy, okresy i bloki.
Co
to jest grupa?
Grupa jest uporządkowaną według wzrastających liczb atomowych kolumną pierwiastków, których atomy mają tę samą liczbę elektronów walencyjnych i ten sam typ konfiguracji walencyjnej. We współczesnym układzie okresowym wyróżnia się 18 grup, grupy główne 1 i 2 oraz od 13 do 18 oraz grupy poboczne od 3 do 12.
Kiedy i dlaczego pojawiają się pierwiastki grup pobocznych?
Pierwiastki grup pobocznych pojawiają się po raz pierwszy w okresie czwartym, a potem w każdym następnym okresie, zawsze wówczas gdy nowo przybywający elektron zajmuje pierwszy stan w nieobsadzonej jeszcze podpowłoce d powłoki n-1. Dzieje się tak dlatego, że po zapełnieniu podpowłoki ns, najniższą energię mają stany w podpowłoce (n-1)d.
Kiedy i dlaczego pojawiają się lantanowce i aktynowce?
Lantanowce i aktynowce pojawiają się odpowiednio w okresie 6 i 7, wówczas gdy nowo przybywający elektron zajmuje pierwszy stan w nieobsadzonej jeszcze podpowłoce f powłoki n-2. Stanowi temu odpowiada najniższa wówczas energia wśród niezajętych stanów.
Co to jest okres?
Okres jest uporządkowanym według wzrastających liczb atomowych szeregiem pierwiastków, których atomy zawierają tę samą liczbę powłok elektronowych. Numer okresu określa liczbę powłok elektronowych.
Kiedy i dlaczego rozpoczyna się nowy okres?
Nowy okres rozpoczyna się wówczas, gdy kolejny, nowo przybywający elektron zajmuje pierwszy stan w nieobsadzonej jeszcze powłoce.
W skrócie:
- nowy okres to rozpoczęcie zabudowy nowej powłoki,
- nowy okres rozpoczyna się dlatego, że po zapełnieniu podpowłoki np, energia stanów w podpowłoce (n+1)s jest najniższa wśród energii wszystkich innych stanów nieobsadzonych podpowłok i ją obsadza nowo pojawiający się elektron.
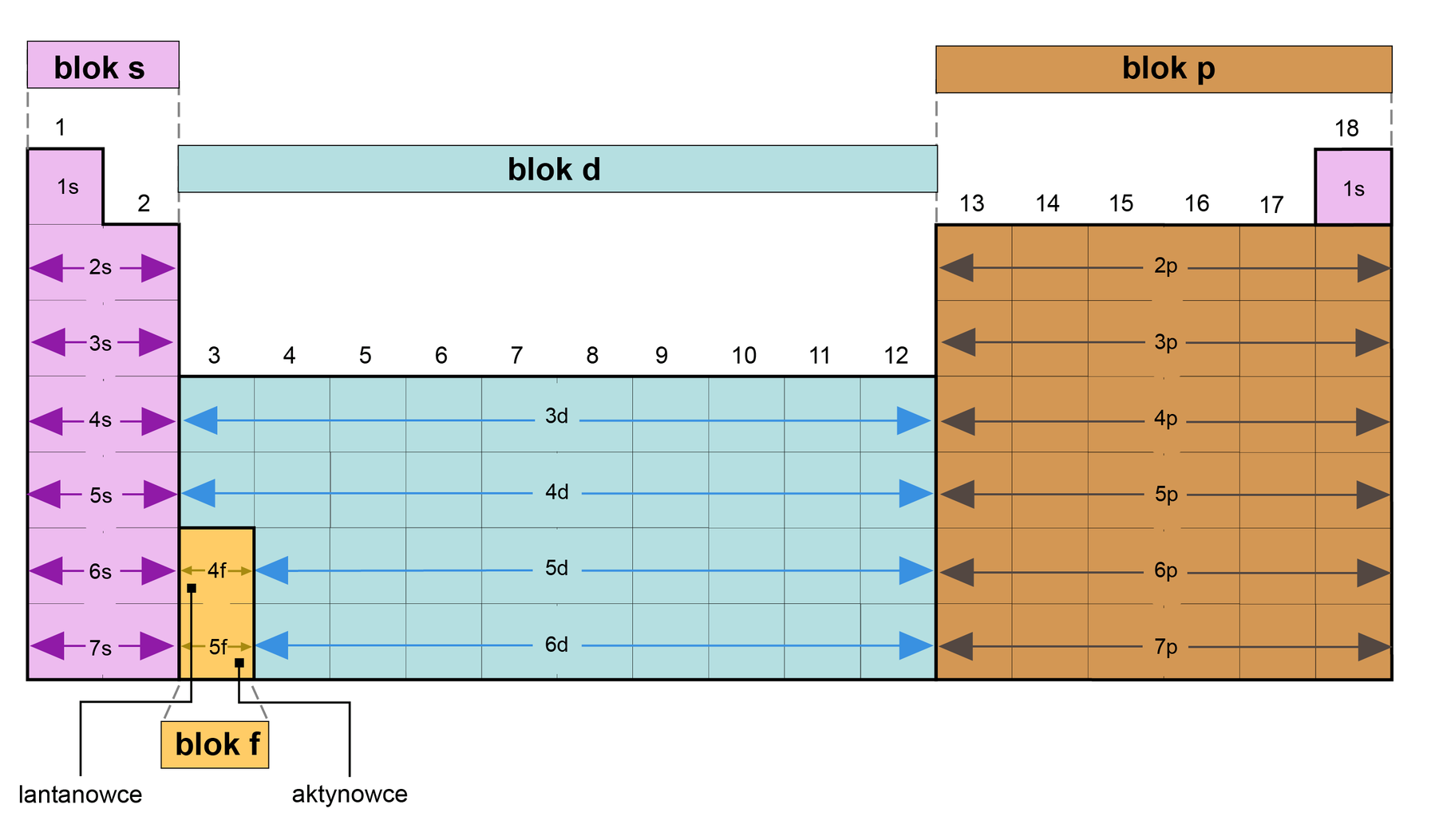
Co to jest blok konfiguracyjny?
Blok konfiguracyjny jest to zbiór pierwiastków o określonym, charakterystycznym typie podpowłokowej konfiguracji walencyjnej:
Grafika: Bloki ergetyczne układu okresowego*. Źródło: GroMar Sp. z o.o., licencja CC BY-SA 3.0.Od czego zależy liczba grup w bloku?
Liczba grup w bloku konfiguracyjnym jest równa pojemności podpowłoki, którą zajmują kolejne, nowo przybywające elektrony w atomach pierwiastków tego bloku.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
3. Prawo okresowości i okresowość fizycznych i chemicznych właściwości pierwiastków
Dzisiaj
prawo okresowości brzmi:
Prawo okresowości jest podstawą konstrukcji układu okresowego.

Ikona (źródło): Reshot
3.1. Promień atomowy
Promienie atomowe to umowna odległość najdalej położonych elektronów występujących w danym atomie od jądra tego atomu. Ustalana teoretycznie dla atomów uczestniczących w hipotetycznych wiązaniach chemicznych są ustalane na drodze teoretycznych obliczeń kwantowo-mechanicznych.
- W okresie w miarę wzrostu liczby atomowej promień atomowy maleje – im większy ładunek jądra, tym silniej przyciąga ono elektrony wszystkich powłok, a więc także i elektrony należące do najbardziej zewnętrznych powłok decydujących o rozmiarach atomu.
- W grupie zwiększająca się liczba powłok elektronowych decyduje o wyraźnym wzroście promienia atomowego ze wzrostem liczby atomowej.
Grafika: Wartości promieni atomowych i jonowych pierwiastków*.
Źródło: GroMar Sp. z o.o., na podstawie K. Pazdro, A. Rola–Noworyta,
Chemia Repetytorium dla przyszłych maturzystów i studentów, Oficyna Edukacyjna Krzysztof Pazdro, Warszawa 2014,
licencja: CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
3.2. Energia jonizacji
- Minimalna energia potrzebna do oderwania elektronu z obojętnego atomu lub cząsteczki w stanie podstawowym - I energią jonizacji.
- Jest miarą zdolności atomów do tworzenia kationów.
- Zależy od najważniejszych wielkości charakteryzujących atom.
- Wyznacza się na podstawie pomiarów spektroskopowych i wyraża w eV/atom lub kJ/mol.
- O energii jonizacji decydują siły, które w atomie działają na elektrony walencyjne. Zależą one przede wszystkim od odległości elektronu od jądra oraz od efektywnego ładunku jądra.
- II energia jonizacji to
najmniejsza ilość energii potrzebna do oderwania jednego elektronu od jednododatniego jonu.
- III energia jonizacji i kolejne
EI < EII < EIII < … < En
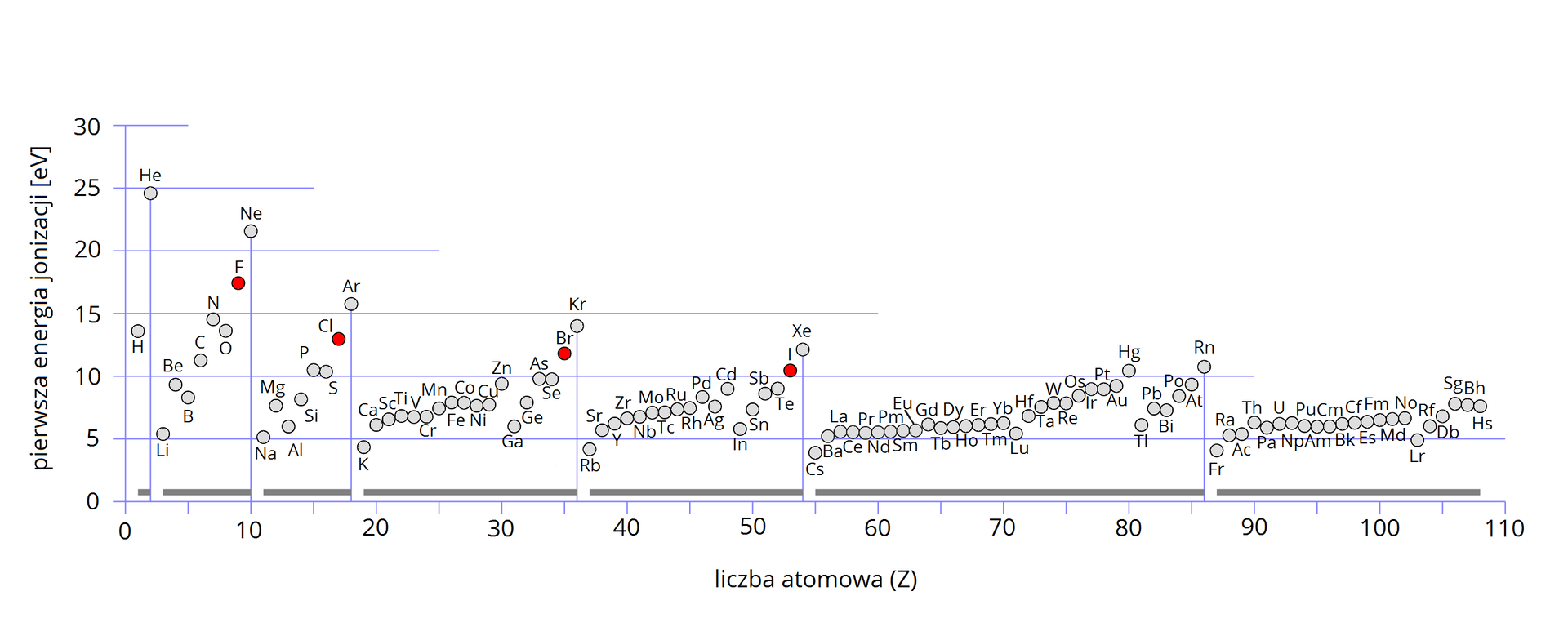
Grafika: Wykres przedstawiający wartości pierwszej energii jonizacji atomów pierwiastków chemicznych w zależności od ich liczby atomowej*.
Źródło: Sponk, zmienione, dostępny w internecie: commons.wikimedia.org, licencja CC BY 3.0.
- W poszczególnych okresach układu okresowego najmniejsze wartości przyjmuje energia jonizacji pierwiastków o największym promieniu atomowym → litowców → w miarę zwiększania się liczby elektronów obserwujemy wzrost energii jonizacji do maksimum dla pierwiastków na końcu okresu → helowców.
- W obrębie poszczególnych grup układu okresowego stwierdzamy wyraźne zmniejszenie energii jonizacji, w miarę wzrostu liczby atomowej → wzrost promienia atomowego.

Ikona (źródło): Reshot
3.3. Promień jonowy
- Odległość najbardziej oddalonych elektronów od jądra atomu w przypadku jonów utworzonych z jednego atomu lub też od geometrycznego centrum jonów złożonych z większej liczby atomów.
- Promienie jonowe wyznacza się na podstawie badań rentgenostrukturalnych uśredniając długości wiązań jonowych, jakie tworzy dany jon z różnymi przeciw jonami.
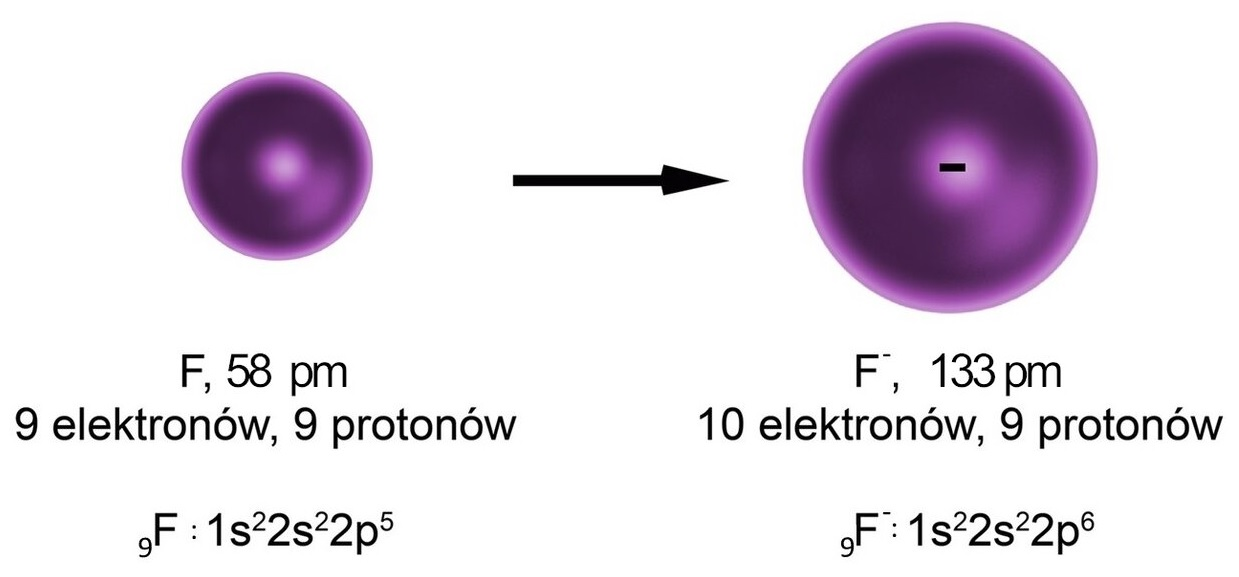
- W przypadku jonów prostych, dla anionów, ich promienie jonowe są większe od promieni tworzących ich atomów, zaś w przypadku kationów jest odwrotnie. Czym większy ładunek ujemny posiada dany anion, tym jego promień jest większy; a czym większy ładunek dodatni ma kation, tym jego promień jest mniejszy.
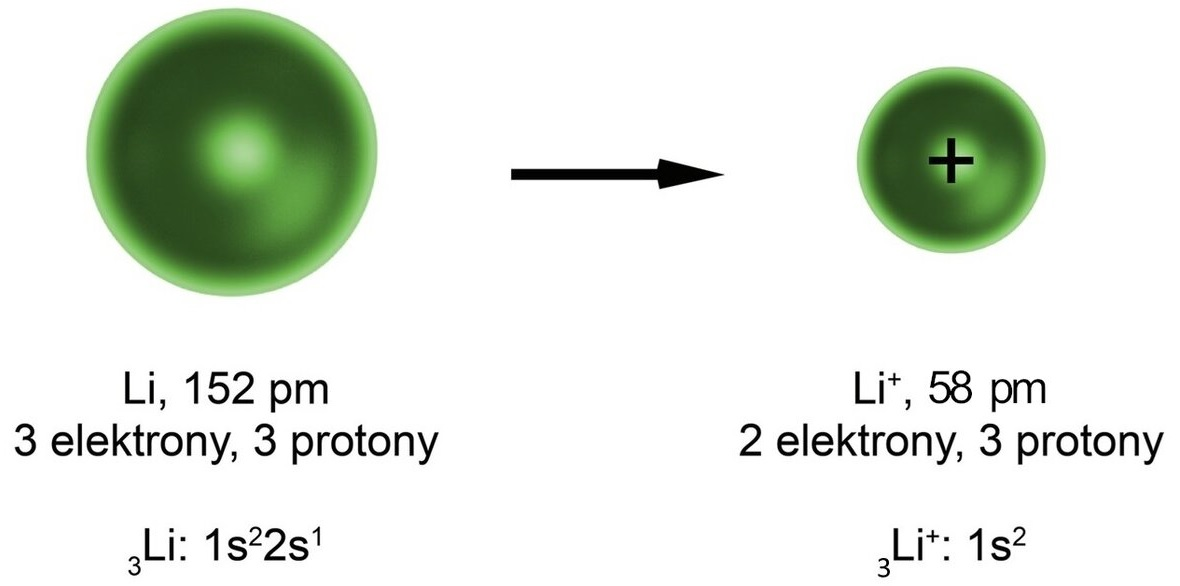
Grafika: Atom litu traci elektron, dlatego promień kationu litu jest mniejszy od promienia atomu litu*.
Źródło: GroMar Sp. z o.o., licencja CC BY-SA 3.0.
Grafika: Atom fluoru zyskuje elektron, dlatego promień anionu fluorkowego jest większy od promienia atomu fluoru*. Źródło: GroMar Sp. z o.o., licencja CC BY-SA 3.0.
- Oderwanie jednego lub więcej elektronów z atomu (czyli utworzenie kationu) musi skutkować zmniejszeniem się promienia chmury elektronowej r, zaś przyłączenie jednego lub więcej elektronów wymusza zwiększenie tego promienia.
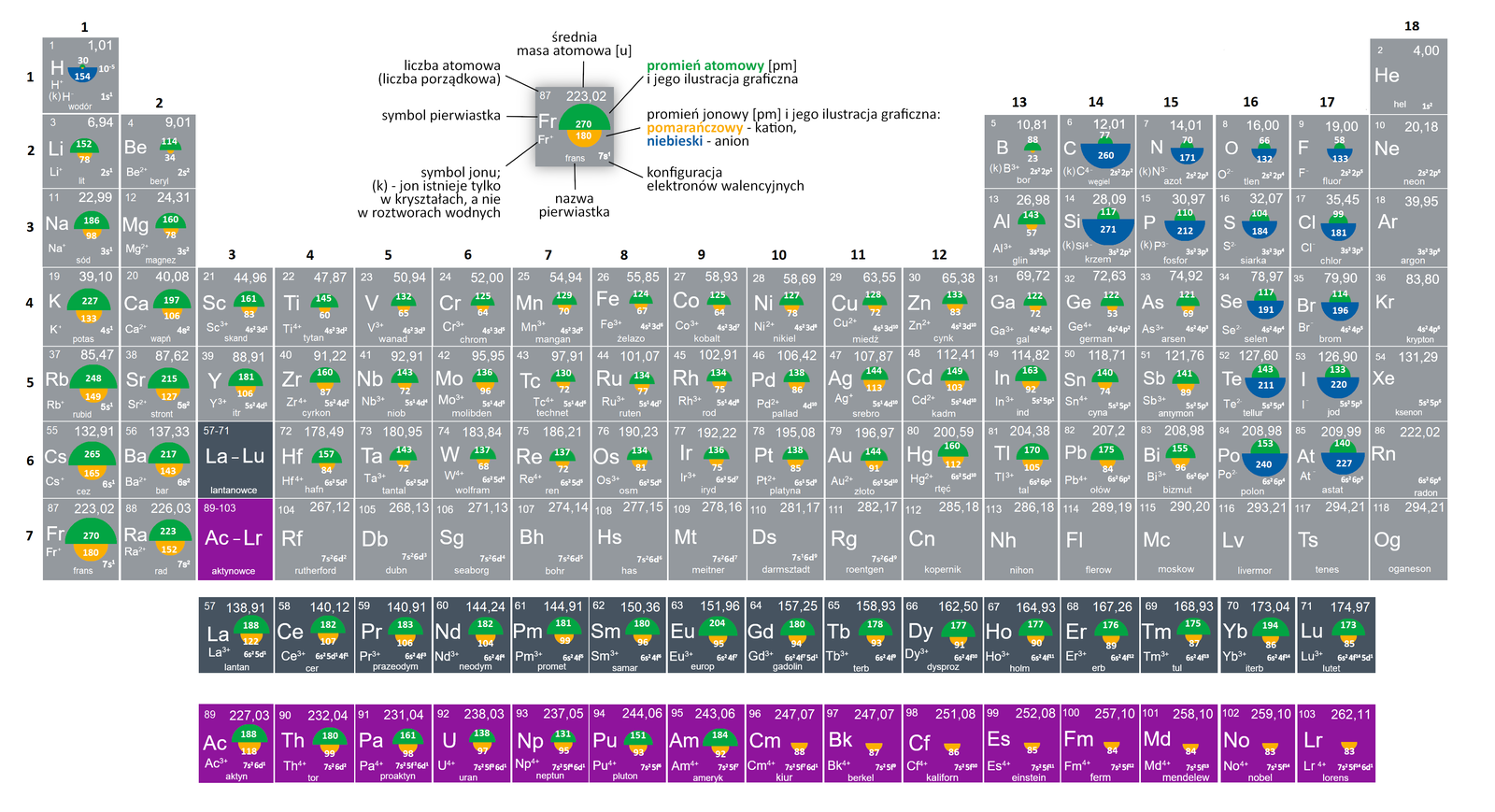
Grafika: Wartości promieni atomowych i jonowych pierwiastków*.
Źródło: GroMar Sp. z o.o., na podstawie K. Pazdro, A. Rola–Noworyta,
Chemia Repetytorium dla przyszłych maturzystów i studentów, Oficyna Edukacyjna Krzysztof Pazdro, Warszawa 2014,
licencja CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
3.4. Elektroujemność
- Zdolność atomu wchodzącego w skład cząsteczki do przyciągania ku sobie elektronów.
- Ma znaczenie jedynie jakościowe.
- Elektroujemność pierwiastków jest często zależna od układu atomów w danym związku, ich stopnia utlenienia, przyjętej w danym momencie hybrydyzacji i dość często zdarza się, że wiązania polaryzują się odwrotnie niżby to wynikało z formalnej elektroujemności związanych pierwiastków.
- Zaproponowano wiele sposobów, aby ilościowo zdefiniować ogólną elektroujemność pierwiastków, np.
- Skala Paulinga,
- Skala Allreda-Rochowa,
- Skala Mullikena.
Aby dowiedzieć się więcej, obejrzyj film Elektroujemność w ujęciu teoretycznym i praktycznym.
Film: Elektroujemność w ujęciu teoretycznym i praktycznym*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
- Jest oparta na pomiarach energii i polaryzacji wiązań prostych dwuatomowych związków chemicznych.
- Jest skalą empiryczną opartą na doświadczalnych wielkościach termodynamicznych. Miarą różnicy elektroujemności pierwiastków A i B na skali Paulinga jest różnica energii wiązania heterojądrowego A-B i średniej energii homojądrowych wiązań A-A i B-B.
- Zgodnie z tą skalą największą elektroujemność ma fluor (E = 4), najmniejszą – cez i frans (E = 0,7), pozostałe pierwiastki są umieszczone pomiędzy.
- Elektroujemność wg Paulinga jest zależna od liczby elektronów występujących w atomach danego pierwiastka i kwadratu jego promienia walencyjnego.
- Duża elektroujemność jest cechą charakterystyczną niemetali – pierwiastków zgrupowanych w prawym górnym trójkącie układu okresowego. Metale mają małą elektroujemność i w tym przypadku charakteryzuje ona zdolność atomu do oddawania elektronów.
- Wzrasta w okresach od strony lewej ku prawej.
- Maleje w grupach układu okresowego ze wzrostem liczby atomowej.
- W grupach głównych i pobocznych elektroujemność zmniejsza się przy przejściu od pierwiastków lżejszych do cięższych.
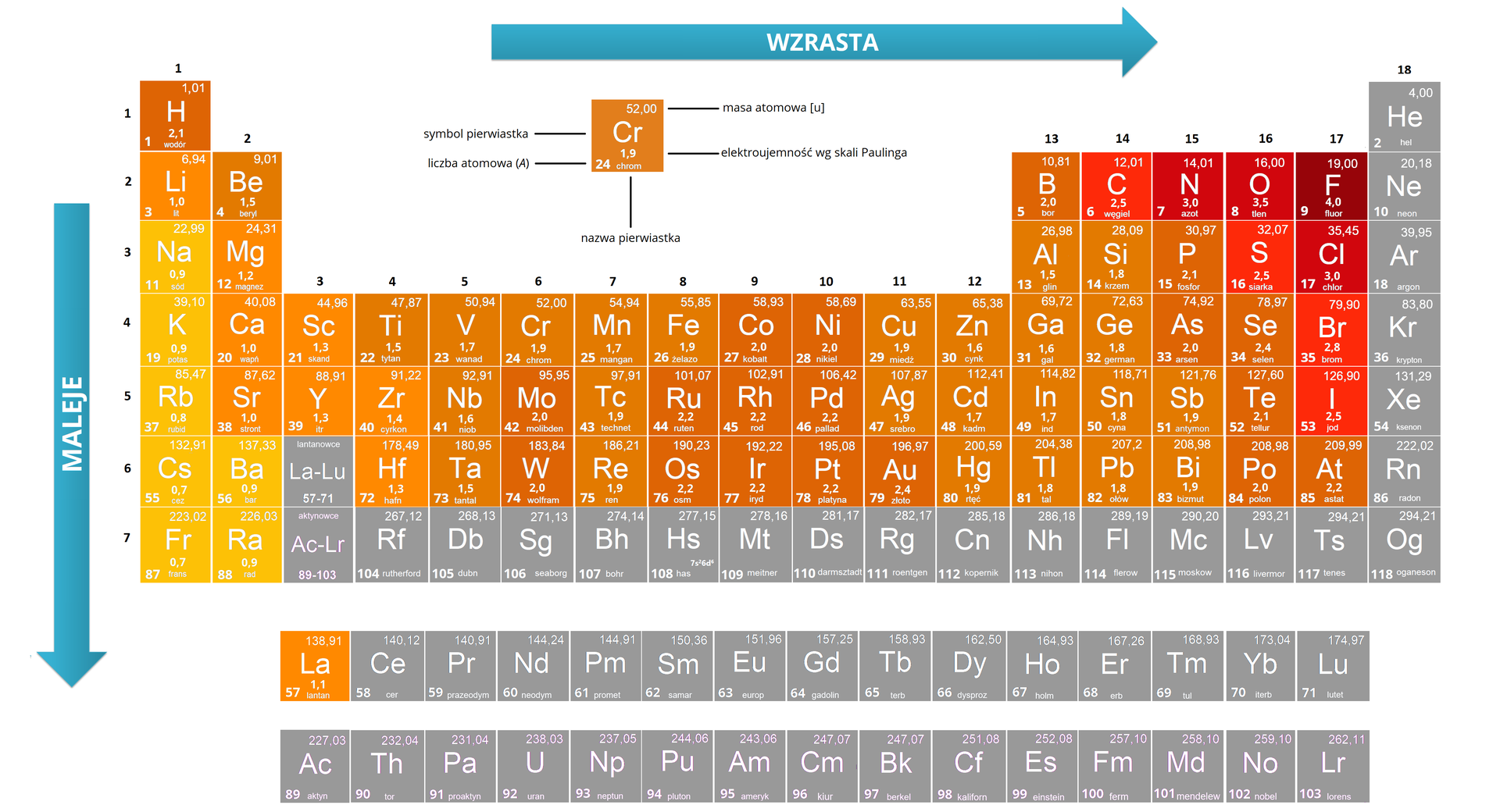
Grafika: Elektroujemność na tle układu pierwiastków*.
Źródło: GroMar Sp. z o.o., na podstawie W. Mizerski, Tablice chemiczne, Warszawa 2004.,
licencja CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
3.5. Powinowactwo elektronowe
- Wielkość charakteryzująca zdolność atomu (lub cząsteczki) w stanie podstawowym do przyłączania elektronu i tworzenia jonu ujemnego (anionu).
- Ilościowo określa się ją jako energię, która wydziela się w wyniku tego procesu. Tradycyjnie energię tę podaje się w elektronowoltach (eV).
- Powinowactwo elektronowe jest pośrednią miarą elektroujemności pierwiastków chemicznych. Im większa wartość powinowactwa, tym większa elektroujemność pierwiastka.
- Powinowactwo elektronowe pierwiastków grup głównych staje się mniej ujemne z przejściem w dół grupy. Atomy o największym promieniu, które mają najniższe energie jonizacji (powinowactwo do własnych elektronów walencyjnych), mają też najniższe powinowactwo dla dodawanych elektronów.
- Istnieją jednak dwa główne wyjątki od tej tendencji:
- Wartości
powinowactwa elektronów pierwiastków B do F w drugim okresie są mniej ujemne
niż w przypadku elementów znajdujących się bezpośrednio pod nimi w trzecim
okresie. Pierwiastki okresu trzeciego (n = 3) mają najniższe wartości
powinowactwa elektronowego.
- Wartości
powinowactwa elektronowego metali ziem alkalicznych są bardziej ujemne dla pierwiastków od Be do Ba. Tworzenie się anionów
pierwiastków cięższych jest energetycznie korzystniejsze.
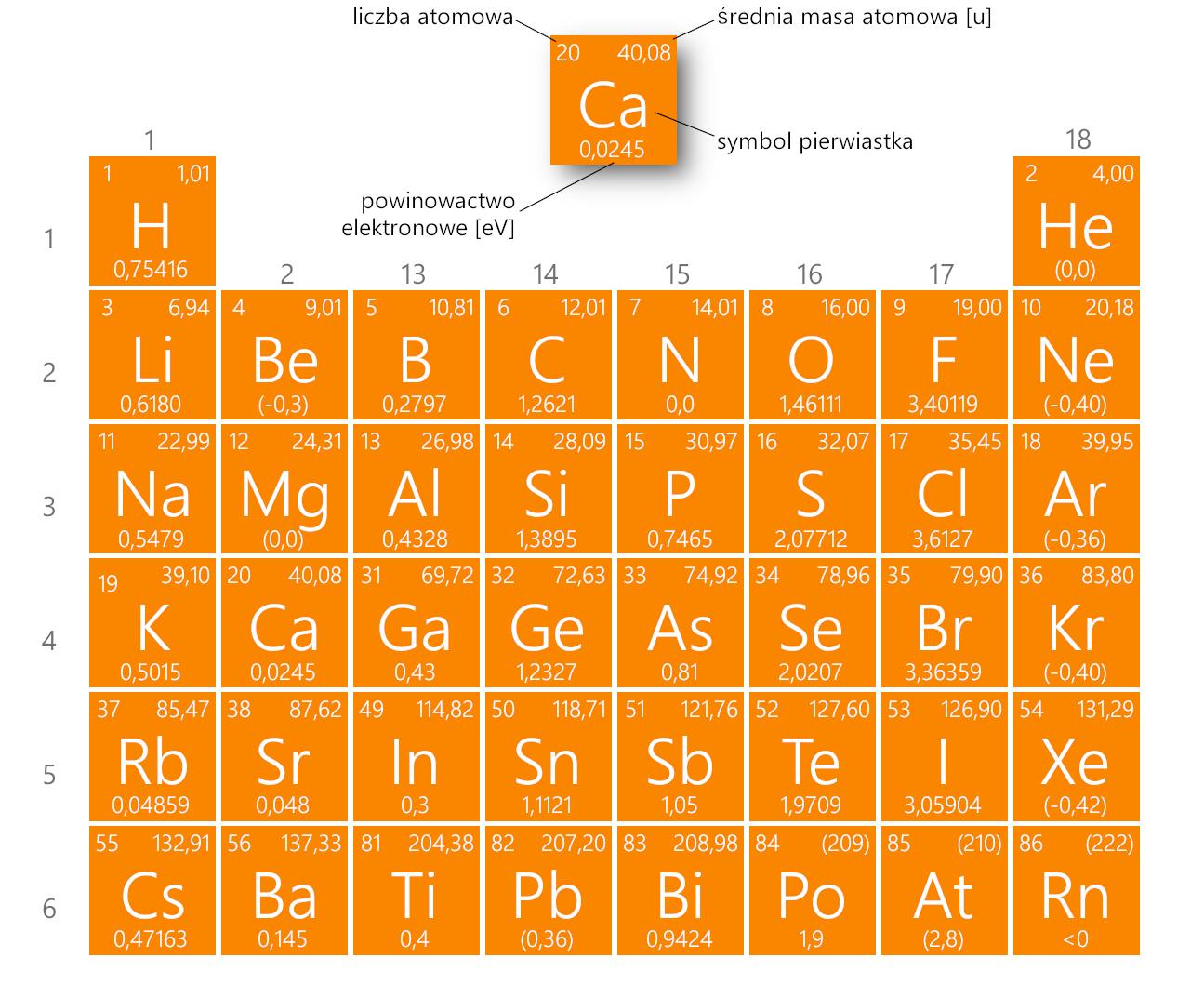
Grafika: Powinowactwo elektronowe pierwiastków grup głównych [eV]*. Źródło: GroMar Sp. z o.o., na podstawie Mizerski W., Tablice Chemiczne, Adamantan, 2004, licencja CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
4. Bibliografia
Adam Bielański, Podstawy chemii nieorganicznej. Warszawa : Wydawnictwo Naukowe PWN, 2013.
Robert Gill, Chemical Fundamentals of Geology and Environmental Geoscience. Sussex : Wiley-Blackwell, 2015.
Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.
Dariusz Witowski, Jan S. Witowski, Chemia - zbiór zadań wraz z odpowiedziami - tom 1-4 (2002-2019) dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii. Łańcut : Oficyna Wydawnicza "Nowa Matura".
Ikona (źródło): Reshot