Wiązania chemiczne
| Strona: | Open AGH - Otwarte Zasoby Edukacyjne |
| Kurs: | Elementy chemii nieorganicznej dla geologów |
| Książka: | Wiązania chemiczne |
| Wydrukowane przez użytkownika: | Guest user |
| Data: | piątek, 30 stycznia 2026, 09:04 |
Spis treści
- 1. Dlaczego atomy łączą się ze sobą?
- 2. Wzory elektronowe
- 3. Rodzaje wiązań chemicznych
- 4. Wiązania kowalencyjne
- 5. Wiązania jonowe
- 6. Wiązanie metaliczne
- 7. Wiązania chemiczne a właściwości substancji
- 8. Wiązanie wodorowe
- 9. Jak rozpoznać z jakim rodzajem wiazania chemicznego mamy do czynienia?
- 10. Bibliografia
1. Dlaczego atomy łączą się ze sobą?
Przyczyną
przekształcania się atomów w inne drobiny jest dążenie do obniżenia ich energii.
Obniżenie energii łączących się atomów następuje wówczas, gdy każdy z nich uzyskuje odpowiednią konfigurację walencyjną – konfigurację walencyjną helowca najbliższego w układzie okresowym dla wiążących się atomów - Reguła helowca.
Konfiguracja walencyjna helowca to odpowiednio:
- dwa elektrony walencyjne (dublet elektronowy) - jeśli powłoką zewnętrzną jest powłoka pierwsza,
- osiem elektronów walencyjnych (oktet elektronowy) - gdy powłoką zewnętrzną jest każda powłoka następna (druga, trzecia).
Atomy
nie będące helowcami starając się zmienić swoją konfiguracje elektronową na
bardziej trwałą przez:
- przyjęcie lub oddanie odpowiedniej liczby elektronów z wytworzeniem trwałych jonów – wiązanie jonowe,
- uwspólnienie odpowiedniej liczby elektronów – wiązania kowalencyjne (atomowe) o różnym stopniu polaryzacji (niespolaryzowane, spolaryzowane),
- przyjęcie do swej sfery elektronowej par elektronów od innego atomu lub grupy atomów – wiązania koordynacyjne,
- delokalizacja elektronów – wiązanie metaliczne.
2. Wzory elektronowe
 Obejrzyj film pt. Tworzenie wzorów jonów złożonych.
Obejrzyj film pt. Tworzenie wzorów jonów złożonych.
Mechanizm tworzenia wiązań chemicznych, można przedstawić z użyciem wzorów elektronowych Lewisa. Są to wzory strukturalne z zaznaczonym rozmieszczeniem par elektronowych wiążących (elektrony wspólne) i niewiążących (wolne pary elektronowe)
Wyróżnić można trzy rodzaje wzorów elektronowych:
- kropkowe (każdy pojedynczy elektron przedstawiany jest za pomocą kropki),
- kreskowo–kropkowe (wiążąca para elektronowa przedstawiona jest kreską, a wolna para elektronowa zaznaczona jest jako dwie kropki),
- kreskowe (każda para elektronów przedstawiana jest za pomocą kreski).
Poniżej przedstawiono sposób tworzenia wzorów elektronowych na przykładzie cząsteczki fluorowodoru:
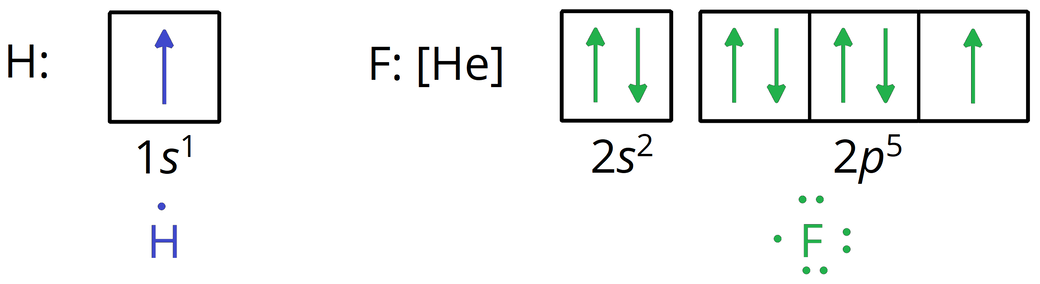
- wzór elektronowy kropkowy
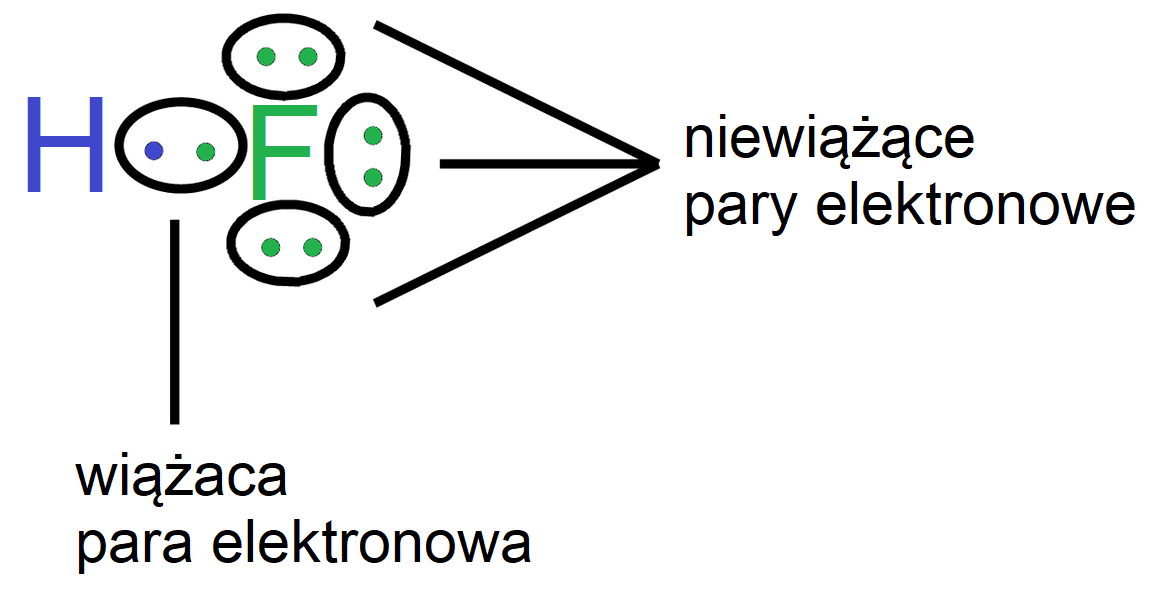
- wzór elektronowy kreskowo–kropkowy
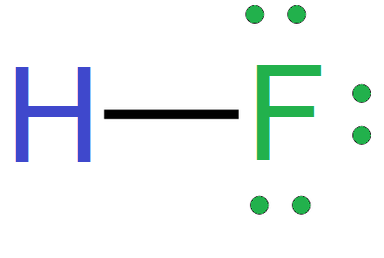
- wzór elektronowy kreskowy
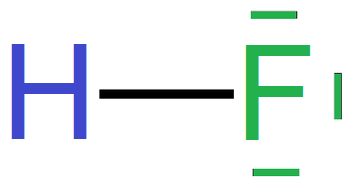
W przypadku natomiast wiązań koordynacyjnych gdzie para elektronowa pochodzi od jednego atomu tworzącego wiązanie – donora, i jest przesunięta w kierunku drugiego atomu – akceptora, wiązanie to można zaznaczyć we wzorach kreskowych i kreskowo‑kropkowych strzałką skierowaną w stronę akceptora.Grafiki: Tworzenie wzoru elektronowego cząsteczki fluorowodoru*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Poniżej przedstawiono sposób tworzenia wzorów elektronowych na przykładzie cząsteczki fluorowodoru:
- wzór elektronowy kropkowy
- wzór elektronowy kreskowo–kropkowy

- wzór elektronowy kreskowy
Grafiki: Tworzenie wzoru elektronowego cząsteczki fluorowodoru*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

3. Rodzaje wiązań chemicznych
Główne rodzaje wiązań chemicznych
- Wiązania chemiczne wytwarzają się wskutek oddziaływań elektrostatycznych pomiędzy elektronami i jądrami łączących się atomów.
- Charakter wiązania chemicznego i jego właściwości zależą od wielu czynników, np. od ładunku jąder atomowych, konfiguracji elektronowych, rozmiarów łączących się atomów. Czynniki te zmieniają się, z przejściem od pierwiastka do pierwiastka.
- Można wyróżnić trzy główne rodzaje wiązań chemicznych: wiązanie kowalencyjne, wiązanie jonowe oraz wiązanie metaliczne, a pozostałe wiązania można traktować jako wiązania o charakterze przejściowym.
 Nurtuje Cię pytanie Jak powstają wiązania chemiczne?* Obejrzyj film, może uzyskasz odpowiedź na nie.
Nurtuje Cię pytanie Jak powstają wiązania chemiczne?* Obejrzyj film, może uzyskasz odpowiedź na nie.
_________________Film: Jak powstają wiązania chemiczne?*. Źródło: GroMar Sp. z o.o., Barbara Rolka, licencja: CC BY-SA 3.0.
* Materiały zamieszczone są na Zintegrowanej Platformie Edukacyjnej.
4. Wiązania kowalencyjne
Wiązanie kowalencyjne (atomowe) polega na uwspólnieniu jednej lub kilku par elektronowych, dzięki czemu każdy z wiążących się atomów zachowuje się tak, jakby miał trwałą konfiguracje gazu szlachetnego.
Istotą wiązania kowalencyjnego jest istnienie wspólnych elektronów, stanowiących pary o skompensowanych spinach.
Pozostałe elektrony walencyjne, które nie biorą udziału w tworzeniu wiązania, określa się jako wolne. Tworzą one pary o skompensowanych spinach i stąd określa się je jako wolne pary elektronowe.
Wyróżnia się dwa rodzaje wiązań kowalencyjnych:
- Wiązanie kowalencyjne niespolaryzowane – wspólna para elektronowa należy w takiej samej mierze do jednego z wiążących się atomów jak i do drugiego,
- Wiązanie kowalencyjne spolaryzowane – wspólna para elektronowa (pary elektronowe) są przesunięte w kierunku atomu o większej elektroujemności,
- Wiązanie koordynacyjne (donorowo-akceptorowe) - wspólna para elektronowa pochodzi tylko od jednego z wiążących się atomów, zwanego donorem.
 Aby dowiedzieć się więcej obejrzyj film „Jak powstają wiązania kowalencyjne?”
Aby dowiedzieć się więcej obejrzyj film „Jak powstają wiązania kowalencyjne?”
Film: Jak powstają wiązania kowalencyjne?*. Źródło: GroMar Sp. z o.o., Barbara Rolka, licencja: CC BY-SA 3.0.
* Materiały zamieszczone są na Zintegrowanej Platformie Edukacyjnej.
4.1. Wiązanie kowalencyjne niespolaryzowane
Wiązanie kowalencyjne niespolaryzowane – utworzenie jednej lub więcej wspólnych par elektronowych wchodzących równocześnie w układy elektronowe obu łączących się atomów, każdy z atomów dostarcza jednakowej liczby elektronów do wspólnego użytku
Dla przykładu:
- Wodór to pierwiastek chemiczny, którego atomy w normalnych warunkach występują w postaci dwuatomowych cząsteczkach. Wiązanie pomiędzy atomami wodoru polega na oddaniu do wspólnego użytku po jednym elektronie przez każdy z atomów, uwspólnienie elektronów w celu utworzenia wspólnej (wiążącej) pary elektronowej.

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0.
[na podst. Wzór kropkowy elektronów w cząsteczce wodoru*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0].
- W przypadku dwuatomowej cząsteczki chloru oprócz wiążących par elektronowych, w cząsteczkach znajdują się także tzw. niewiążce pary elektronowe. Nie biorą one bezpośredniego udziału w tworzeniu wiązania chemicznego.

Grafika: Rodzaje par elektronowych w cząsteczce chloru. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0.
Atomy niemetali mogą uwspólniać więcej niż jedną parę elektronową.
- Cząsteczka tlenu - atom tlenu ma sześć elektronów walencyjnych, a do uzyskania ośmiu elektronów na ostatniej powłoce potrzebuje dwóch. Dlatego każdy z atomów tlenu w cząsteczce oddaje do wspólnego użytku po dwa elektrony. Między atomami tlenu występują zatem dwie wiążące pary elektronowe. Takie wiązanie określa się mianem wiązania podwójnego. Wzór sumaryczny cząsteczki tlenu to O2.

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Rodzaje par elektronowych w cząsteczce chloru. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0].
- Cząsteczka azotu - atom azotu ma pięć elektronów walencyjnych, a do uzyskania ośmiu elektronów na ostatniej powłoce potrzebuje trzech. Dlatego każdy z atomów azotu w cząsteczce oddaje do wspólnego użytku po trzy elektrony. Między atomami azotu występują zatem trzy wiążące pary elektronowe. Takie wiązanie określa się mianem wiązania potrójnego. Wzór sumaryczny cząsteczki azotu to N2.

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Rodzaje par elektronowych w cząsteczce chloru. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0].
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

4.2. Wiązanie kowalencyjne spolaryzowane
Wiązanie kowalencyjne spolaryzowane – atomy połączone wspólną parą elektronową przyciągają ją w różnym stopniu, co powoduje niesymetryczne rozmieszczenie ładunku elektrycznego w cząsteczce. Wspólna para jest przyciągana przez atom bardziej elektroujemny, przez co następuje deformacja chmury elektronowej i powstanie ładunków cząstkowych.
Są to cząstkowe ładunki dodatni i ujemny na wiążących się atomach, oznaczane symbolami δ+ oraz δ-.
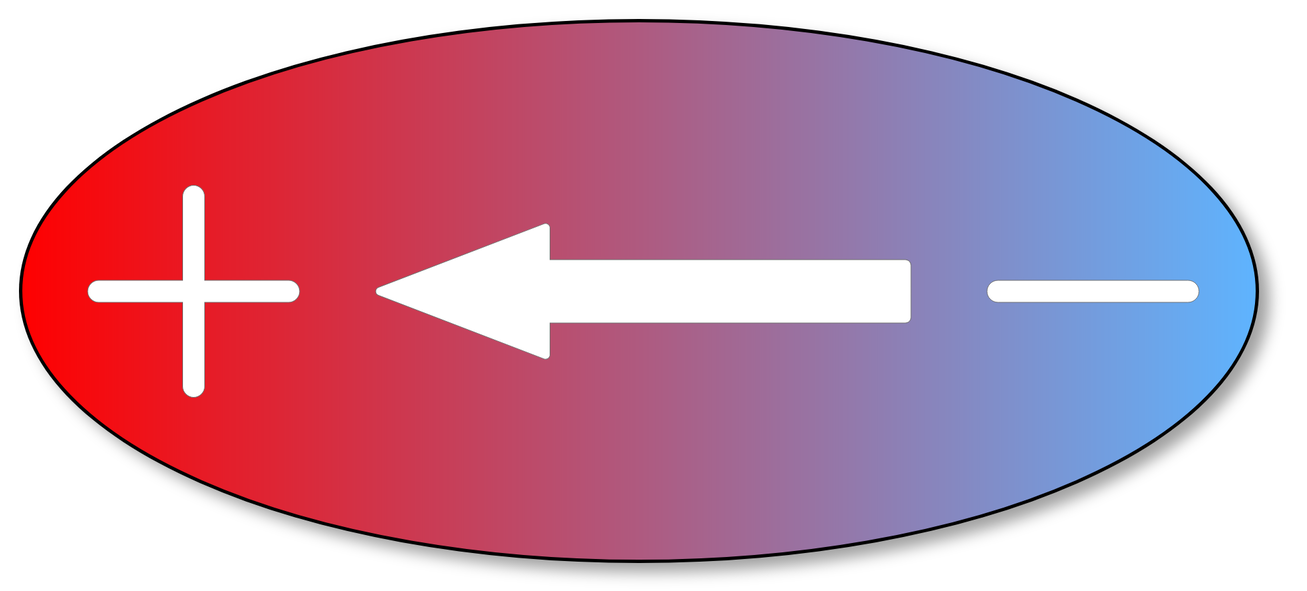
Wartość ładunku cząstkowego występującego w cząsteczkach z wiązaniem kowalencyjnym spolaryzowanym jest znana jedynie z obliczeń. Doświadczalnie można zmierzyć wielkość, tzw. momentu dipolowego.
Moment dipolowy jest wielkością fizyczną, która charakteryzuje właściwości dipola elektrycznego.
Dipol elektryczny to układ składający się z dwóch ładunków punktowych o równych wartościach i przeciwnych znakach, znajdujących się w pewnej odległości od siebie.
Grafika: Dipol elektryczny i elektryczny moment dipolowy*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Wiele cząsteczek z wiązaniem kowalencyjnym spolaryzowanym stanowi dipol. Takie cząsteczki mogą zostać uporządkowane w polu elektrycznym. Natężenie pola elektrycznego, jakie należy zastosować w celu zorientowania dipoli zgodnie z liniami sił pola elektrycznego, zależy od wartości ładunku na końcach dipola - d, i odległości miedzy ładunkami - l.
Miarą zdolności dipola do orientacji w polu elektrycznym jest iloczyn d·l, zwany momentem dipolowym, µ.
Przykłady:Cząsteczki chlorowodoru - każdy z atomów wchodzących w skład cząsteczki chlorowodoru, oddaje po jednym elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej. Para elektronowa, znajdująca się pomiędzy atomami wodoru i chloru, nie należy jednak w jednakowym stopniu do obu atomów, ale jest przesunięta w kierunku tego, który silniej przyciąga elektrony (jest bardziej elektroujemny) – zatem w kierunku atomu chloru. Opisane wiązanie jest wiązaniem kowalencyjnym spolaryzowanym (wiązaniem atomowym spolaryzowanym). Strzałka w kolorze czerwonym wskazuje wypadkowy moment dipolowy w cząsteczce chlorowodoru.
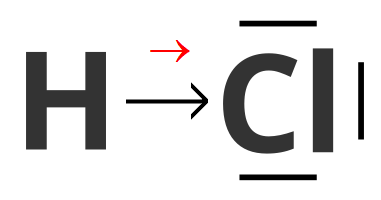
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki chlorowodoru*. Źródło: epodręczniki.pl, licencja: CC BY-SA 3.0].
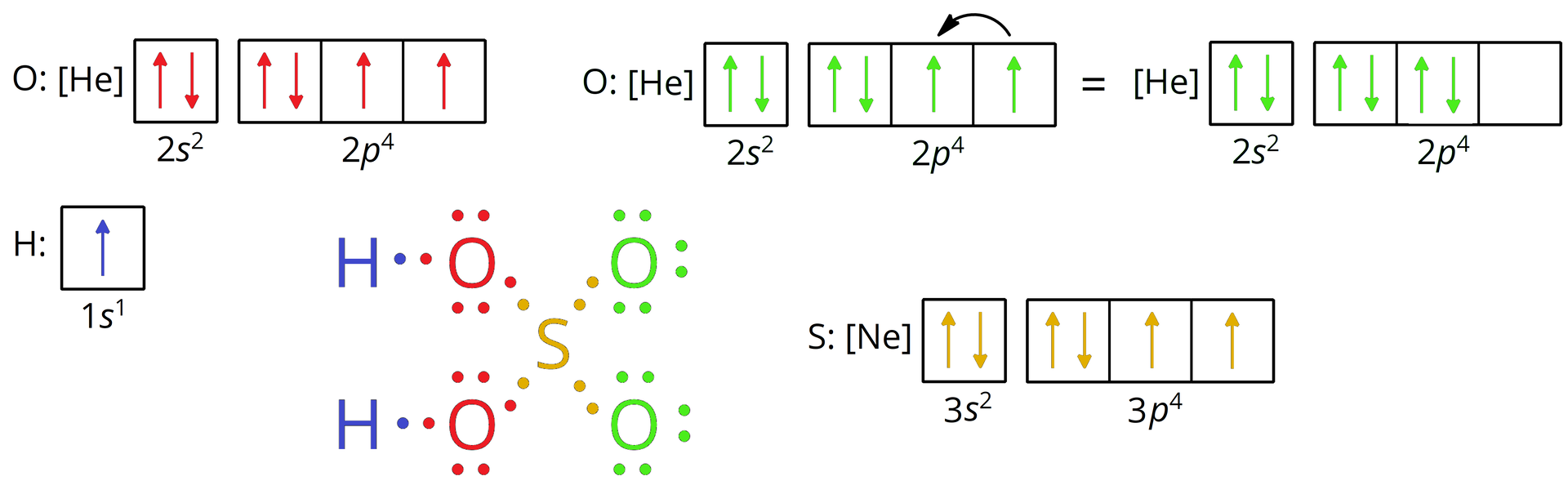
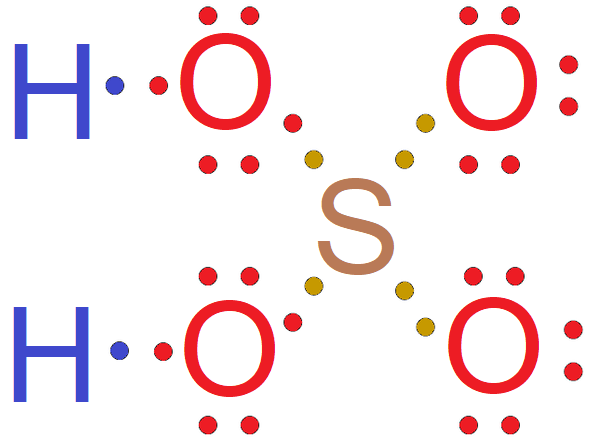
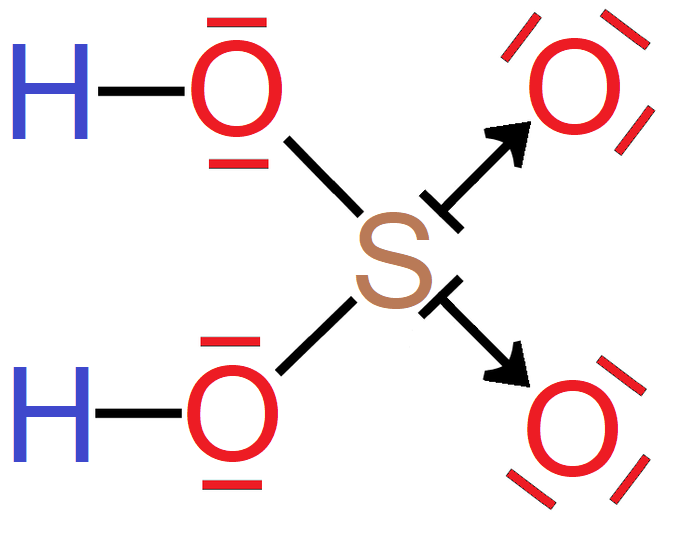
Cząsteczki wody - każdy z atomów wodoru wchodzących w skład cząsteczki wody, oddaje po jednym elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej z atomem tlenu który na rzecz tworzonych wiązań oddaje dwa spośród swoich elektronów walencyjnych. Pary elektronowe, znajdujące się pomiędzy atomami wodoru i atomem tlenu, nie należą jednak w jednakowym stopniu do wiążących się atomów, ale są przesunięte w kierunku bardziej elektroujemnego atomu tlenu. Strzałka w kolorze czerwonym wskazuje wypadkowy moment dipolowy w cząsteczce wody.
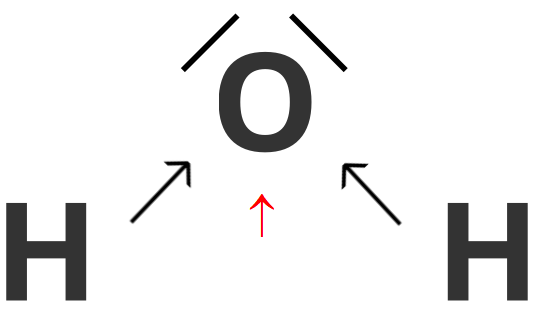
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki wody*. Źródło: epodręczniki.pl, licencja: CC BY-SA 3.0].
Cząsteczka amoniaku - każdy z atomów wodoru wchodzących w skład cząsteczki amoniaku, oddaje po jednym elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej z atomem azotu, który na rzecz tworzonych wiązań oddaje trzy spośród swoich elektronów walencyjnych. Pary elektronowe, znajdujące się pomiędzy atomami wodoru i atomem azotu, nie należą jednak w jednakowym stopniu do wiążących się atomów, ale są przesunięte w kierunku bardziej elektroujemnego atomu azotu. Strzałka w kolorze czerwonym wskazuje wypadkowy moment dipolowy w cząsteczce amoniaku.

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki chlorowodoru*. Źródło: epodręczniki.pl, licencja: CC BY-SA 3.0].
Cząsteczka tlenku węgla(IV) - każdy z atomów tlenu wchodzących w skład cząsteczki tlenku węgla(IV), oddaje po dwa elektrony walencyjne w celu utworzenia wiążących par elektronowych z atomem węgla, który na rzecz tworzonych wiązań oddaje cztery spośród swoich elektronów walencyjnych. Pary elektronowe, znajdujące się pomiędzy atomami tlenu i atomem węgla, nie należą jednak w jednakowym stopniu do wiążących się atomów, ale są przesunięte w kierunku bardziej elektroujemnych atomów tlenu. Z względu na geometrię cząsteczki tlenu węgla(IV) nie jest ona dipolem elektrycznym, ponieważ wypadkowy moment dipolowy w przypadku tej cząsteczki jest zerowy.
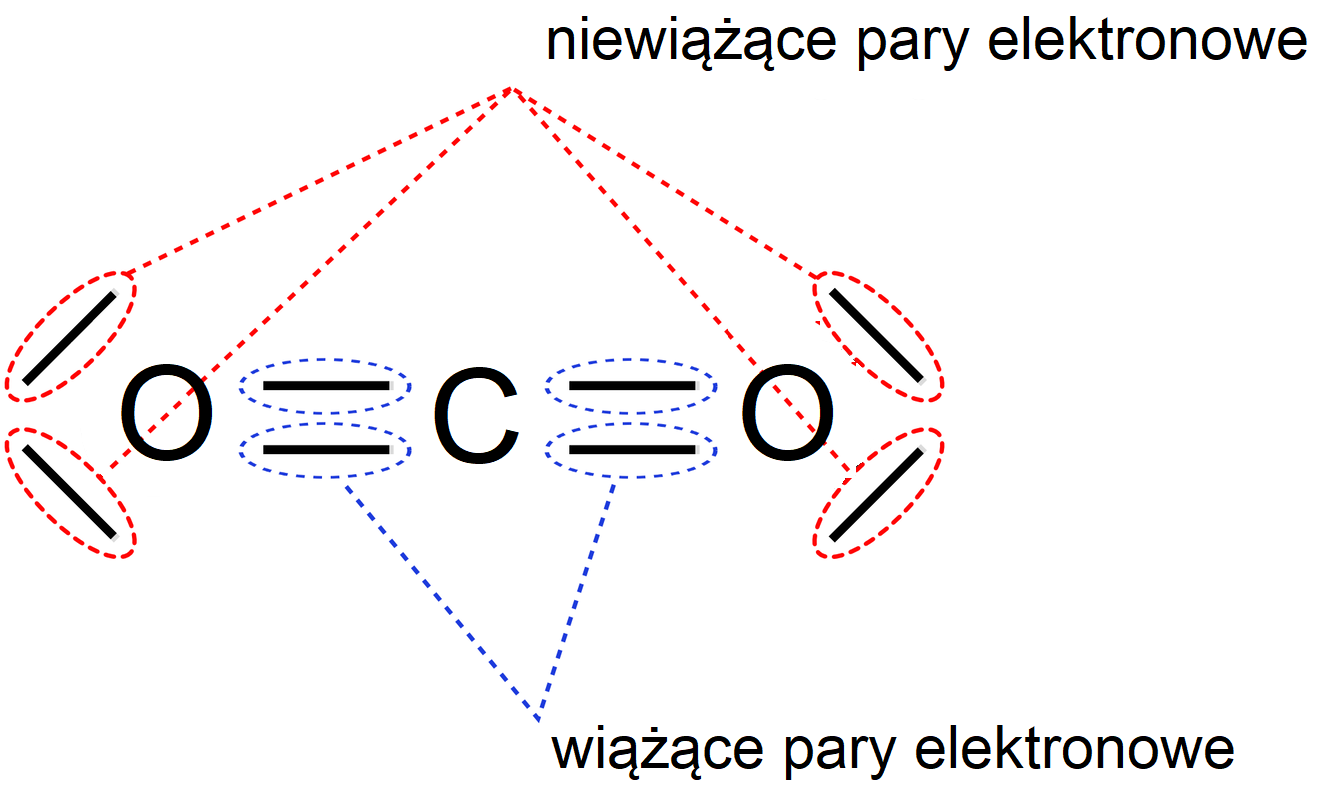
Grafika: Wzór elektronowy kreskowy cząsteczki dwutlenku węgla z wyróżnionymi rodzajami par elektronowych*. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0.
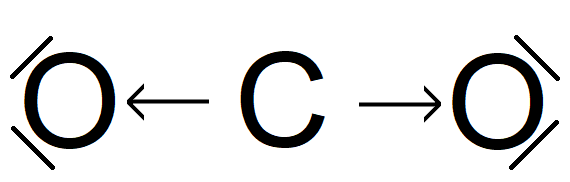
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki tlenku węgla(IV) z zaznaczeniem polaryzacji wiązań*. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0].
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

4.3. Wiązanie koordynacyjne
Wiązanie koordynacyjne polega na uwspólnieniu pary elektronowej pochodzącej tylko od jednego z wiążących się atomów, zwanego donorem. Drugi atom, akceptor, uzupełnia własną powłokę walencyjną o elektrony pochodzące od donora. Graficznie wiązanie to zaznaczane jest strzałką skierowaną od atomu donora w kierunku atomu akceptora.
Przykłady:
1) W wyniku reakcji zachodzącej między cząsteczkami amoniaku i wody w roztworach wodnych, powstaje kation amonowy, w którym obecne jest wiązanie donorowo‑akceptorowe (koordynacyjne). Donorem elektronów w kationie amonowym jest atom azotu posiadający wolną parę elektronową, natomiast akceptorem – atom wodoru.
Poniżej zamieszczono schemat przedstawiający reakcję pomiędzy cząsteczką wody i amoniaku.
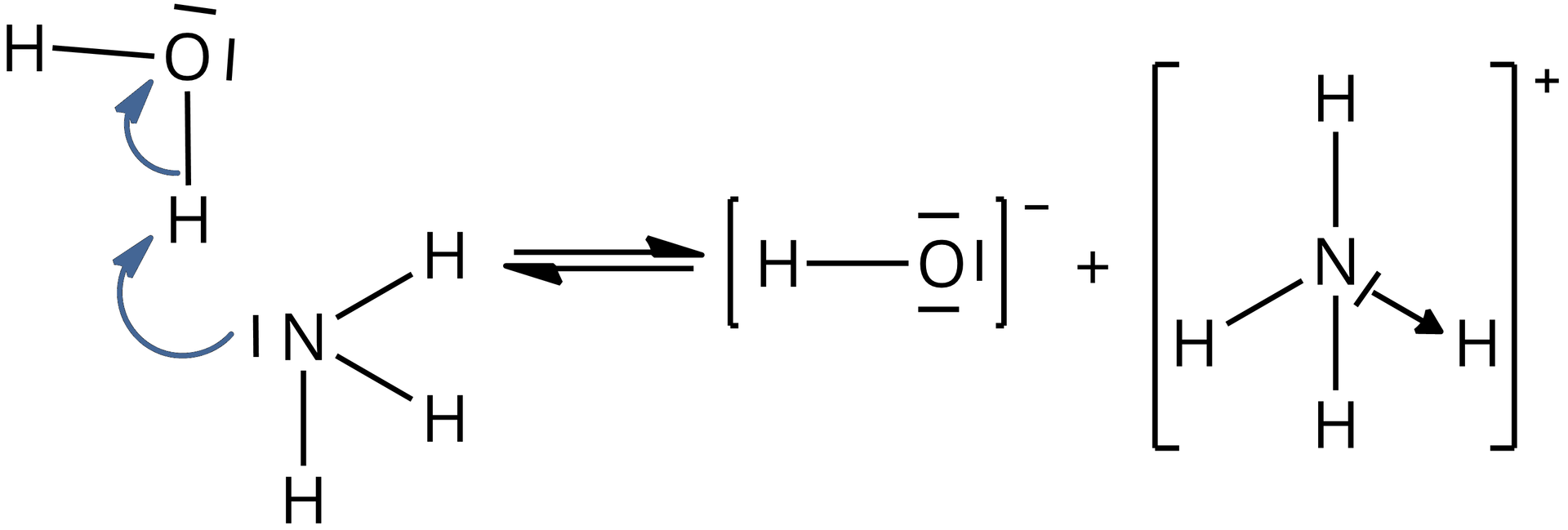
Grafika: Schemat przedstawiający reakcję pomiędzy cząsteczką wody i amoniaku*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
2) Woda w niewielkim stopniu ulega procesowi autodysocjacji. Przebieg tego procesu można zilustrować za pomocą równania reakcji.
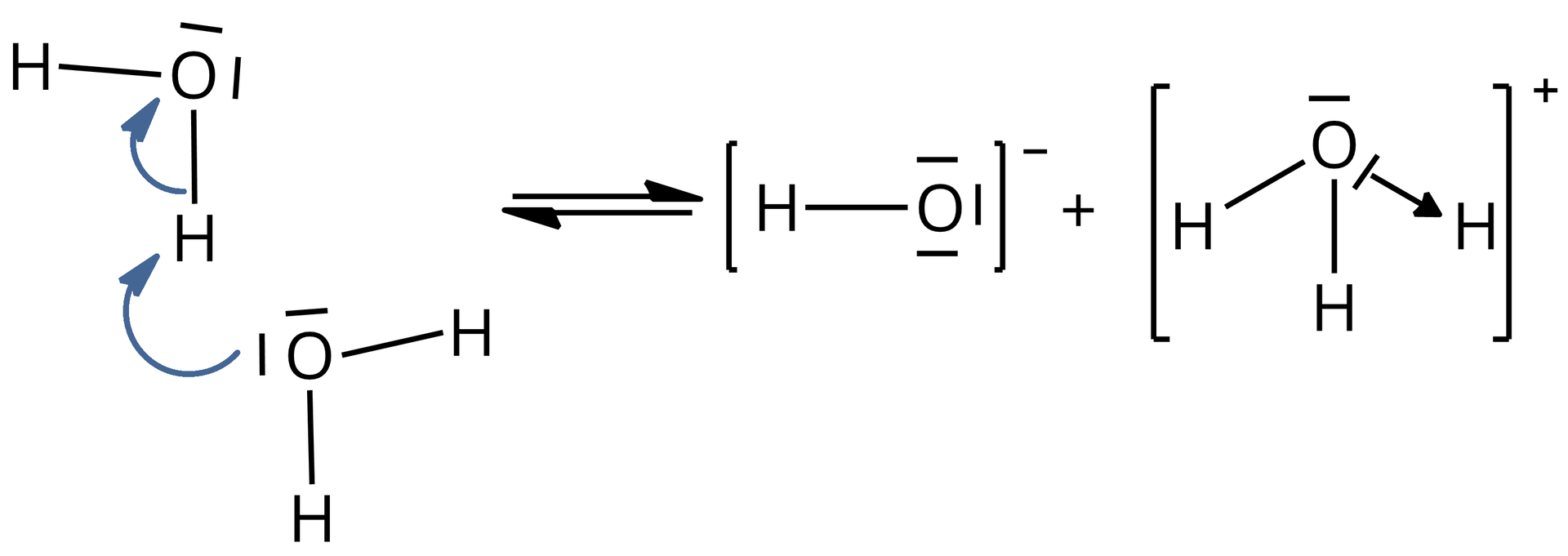
Grafika: Schemat powstawania jonu hydroniowego*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Pomiędzy cząsteczkami wody dochodzi do przemieszczenia się w jednym momencie dwóch elektronów. Tym samym powstaje anion wodorotlenkowy oraz dochodzi także do utworzenia wiązania koordynacyjnego, w wyniku czego z drugiej cząsteczki wody powstaje kation oksoniowy (kation hydroniowy, kation hydronowy). Donorem elektronów w kationie oksoniowym jest atom tlenu, natomiast akceptorem atom wodoru.
 Nurtuje Cię pytanie o Wiązanie koordynacyjne (donorowo-akceptorowe)*? Obejrzyj film, może uzyskasz odpowiedź.
Nurtuje Cię pytanie o Wiązanie koordynacyjne (donorowo-akceptorowe)*? Obejrzyj film, może uzyskasz odpowiedź.
Film: Wiązanie koordynacyjne (donorowo-akceptorowe)*. Źródło: GroMar Sp. z o. o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
_________________
* Wykorzystano materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.

4.4. Orbitale molekularne a wiązania typu sigma i typu pi
Wiązania σ i π
Wiązania kowalencyjne powstają na skutek przenikania się orbitali atomowych, a sposób ich przenikania pozwala na określenie typu wiązania – zazwyczaj są to wiązania pojedyncze lub podwójne
Wiązania pojedyncze powstają w wyniku czołowego nakładania się orbitali atomowych wiążących się atomów, tzn. orbitale atomowe przenikają się na osi łączącej dwa atomy – wiązanie typu σ
W najprostszych wypadkach przenikają się dwa orbitale typu s, dwa orbitale typu p, a także orbital typu s z orbitalem typu p

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Jak powstają wiązania typu sigma?* Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.]
Dla przykładu :
- orbital molekularny powstający poprzez czołowe nałożenie się dwóch orbitali s (o kształcie sferycznym), występuje w cząsteczce H2,
- orbital molekularny powstający poprzez czołowe przenikanie się jednego orbitalu s oraz jednego orbitalu p, występuje w cząsteczce HF,
- orbital molekularny powstający poprzez czołowe przenikanie się dwóch orbitali p, tworzy wiązanie σ w cząsteczce F2.
 Nurtuje Cię pytanie jak powstają orbitale molekularne?* Obejrzyj animację, może uzyskasz odpowiedź.
Nurtuje Cię pytanie jak powstają orbitale molekularne?* Obejrzyj animację, może uzyskasz odpowiedź.
Animacja: Jak powstają orbitale molekularne?*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Orbitale typu p mają dodatkową możliwość przenikania się.
Jeśli dwa orbitale p pochodzące od dwóch różnych atomów mają możliwość ustawienia się idealnie równolegle do siebie, może nastąpić tzw. przenikanie się „boczne” – tworzy się wtedy wiązanie typu π.
Wiązanie π nie występuje samodzielnie, ale towarzyszy wiązaniu σ.
Mamy z nim do czynienia tylko w wypadku występowania w cząsteczce wiązania podwójnego lub potrójnego.
Wiązania π są słabsze od wiązań σ, dlatego podczas reakcji chemicznych to one pierwsze ulegają zerwaniu.
Grafika: Boczne nakładanie się orbitali typu p*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Dla przykładu :
- w dwuatomowej cząsteczce tlenu O2 w wyniku nałożenia się dwóch rodzajów orbitali atomowych ze sobą, pomiędzy atomami tlenu tworzy się wiązanie podwójne (jedno wiązanie typu σ oraz jedno wiązanie typu π),
- w dwuatomowej cząsteczce azotu N2 w wyniku nałożenia się trzech rodzajów orbitali atomowych ze sobą, pomiędzy atomami azotu tworzy się wiązanie potrójne (jedno wiązanie typu σ oraz dwa wiązania typu π).
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

4.5. Orbitale molekularne wiążące i antywiążące
Jeśli atomy zbliżają się do siebie i ich orbitale zaczynają się przenikać, to w efekcie powstają orbitale opisujące stan elektronów w całej cząsteczce.
Wynikiem działania matematycznego na orbitalach dwóch atomów jest równanie, którego rozwiązaniem są dwa orbitale molekularne: jeden o energii niższej nazywany orbitalem wiążącym, a drugi o energii wyższej od energii orbitali atomowych nazywany orbitalami antywiążącymi.
Jeśli elektrony zapełniają orbital o niższej energii to powstaje trwała niskoenergetyczna cząsteczka.
Zatem podczas tworzenia wiązania σ powstają orbitale: o niższej energii orbital wiążący σ i o wyższej energii niż energia orbitali atomowych - orbital antywiążący σ*.
Podobnie podczas tworzenia wiązań π powstają 2 orbitale: wiążący π o energii niższej i antywiążący π * o energii wyższej od orbitali
macierzystych.
 Nurtuje Cię pytanie w jaki sposób można skonstruować diagramy energetyczne prostych cząsteczek?*. Obejrzyj film, może uzyskasz odpowiedź.
Nurtuje Cię pytanie w jaki sposób można skonstruować diagramy energetyczne prostych cząsteczek?*. Obejrzyj film, może uzyskasz odpowiedź.
_________________Film: W jaki sposób można skonstruować diagramy energetyczne prostych cząsteczek?*.
Źródło: GroMar Sp. z o.o., Krystyna Tesak, licencja: CC BY-SA 3.0.
* Materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.

4.6. Jakie właściwości mają substancje o wiązaniach kowalencyjnych?
 Posłuchaj audiobooka pt. "Jakie właściwości mają substancje o wiązaniach kowalencyjnych?"
Posłuchaj audiobooka pt. "Jakie właściwości mają substancje o wiązaniach kowalencyjnych?"
Audiobook: Jakie właściwości mają substancje o wiązaniach kowalencyjnych?*
Źródło: AGroMar Sp. z o.o., licencja: CC BY-SA 3.0._________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
5. Wiązania jonowe
Wiązanie jonowe powstają wówczas gdy, atomy dwóch łączących się pierwiastków zyskują konfigurację elektronową gazów szlachetnych dzięki temu, że atomy pierwiastka określanego jako elektrododatni tracą swoje elektrony walencyjne na rzecz atomów drugiego pierwiastka – elektroujemnego
Wytworzone w ten sposób jony, dodatni (kation) i ujemny (anion), przyciągają się dzięki działaniu sił elektrostatycznych
Jednym z najlepiej poznanych związków o budowie jonowej jest chlorek sodu. Poniżej przedstawiono mechanizm powstawania wiązania między atomem sodu, a atomem chloru:
- w ujęciu graficznym
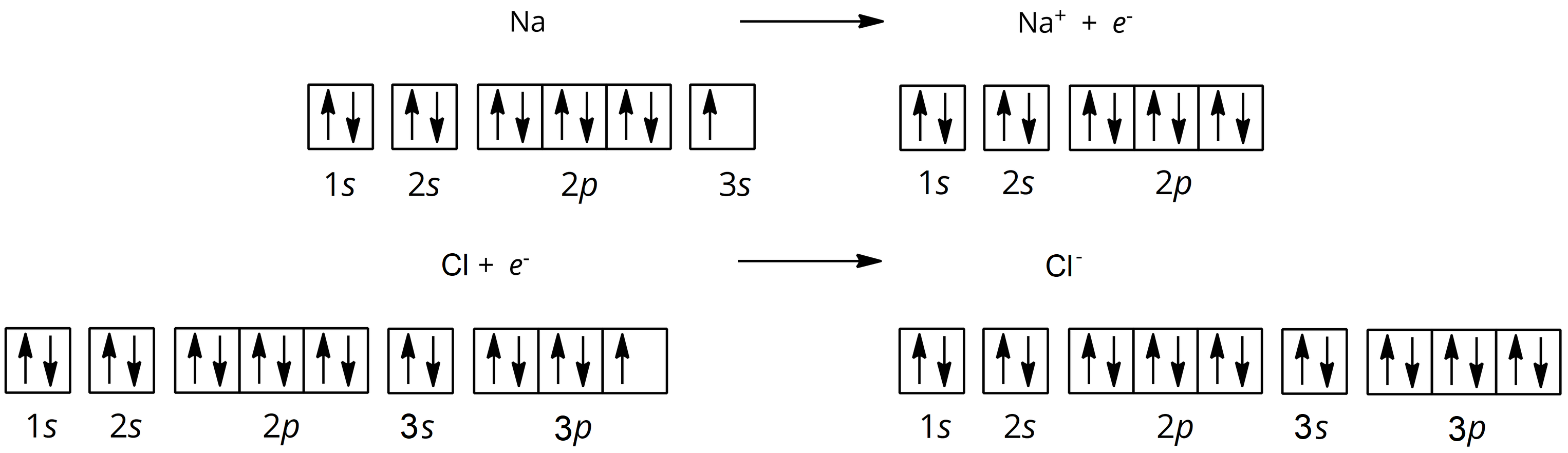
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Zapis graficzny tworzenia wiązania jonowego z wykorzystaniem orbitali*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0].
- w ujęciu powłokowym
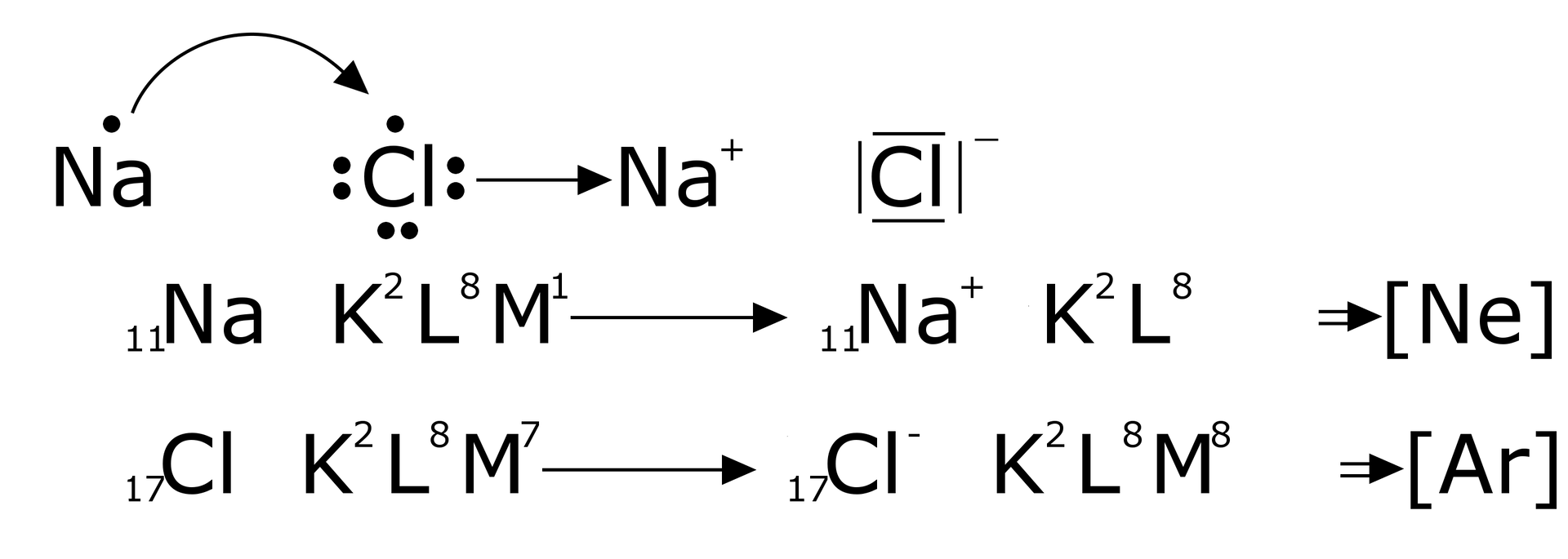
Grafika: Tworzenie jonów dodatnich oraz ujemnym w ujęciu powłokowym*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Ważne!
Należy pamiętać, że nie istnieją pojedyncze cząsteczki związku jonowego. Wzór sumaryczny takiego związku (np. CaO, NaCl) określa rodzaj jonów w sieci krystalicznej oraz ich stosunek ilościowy.
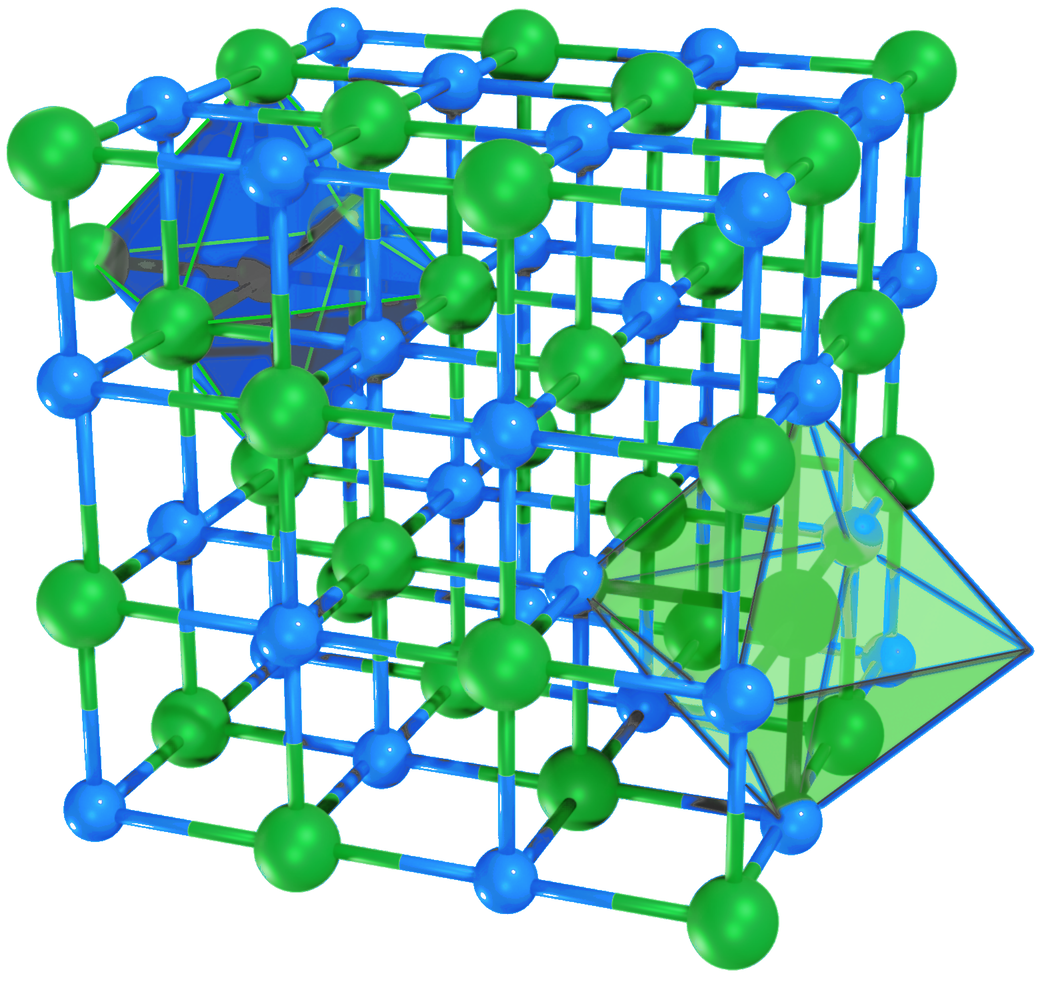
Grafika: Fragment sieci krystalicznej chlorku sodu*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
 Nurtuje Cię pytanie: "Jak powstają wiązania jonowe?* Obejrzyj animacje, może uzyskasz odpowiedź na nie
Nurtuje Cię pytanie: "Jak powstają wiązania jonowe?* Obejrzyj animacje, może uzyskasz odpowiedź na nie
Animacja: Jak powstają wiązania jonowe?*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Wiązanie jonowe, niezależnie od wartości różnicy elektroujemnosci występuje m.in. w:
tlenkach metali aktywnych, np. Na2O, MgO,
wodorkach litowców i berylowców (z wyjątkiem berylu i magnezu), np. NaH, CaH2,
wodorotlenkach metali aktywnych, np. LiOH, KOH,
solach metali aktywnych, np. NaCl, NaNO3.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

5.1. Jakie właściwości mają substancje o wiązaniach jonowych?
 Posłuchaj audiobooka pt. "Jakie właściwości mają substancje o wiązaniach jonowych?"
Posłuchaj audiobooka pt. "Jakie właściwości mają substancje o wiązaniach jonowych?"
Audiobook: Jakie właściwości mają substancje o wiązaniach jonowych?* Źródło: https://zpe.gov.pl/ Na podstawie: Adam Bielański, Podstawy chemii nieorganicznej, Wydawnictwo Naukowe PWN, Warszawa 2010. Aleksander Cyunczyk, Jan Sieniawski, Struktura ciał stałych, Oficyna Wydawnicza Politechniki Rzeszowskiej, Rzeszów 2008. Angela Saunders, Niegel Saunders, Chemistry, Oxford University Press, Oxford 2007. Waldemar Usnalski, Chemia w szkole średniej, Wydawnictwo Naukowo Techniczne, Warszawa 1998.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
6. Wiązanie metaliczne
Wiązanie metaliczne – odznacz się obecnością luźno związanych elektronów, które mogą się łatwo przemieszczać pod wpływem przyłożonego napięcia elektrycznego
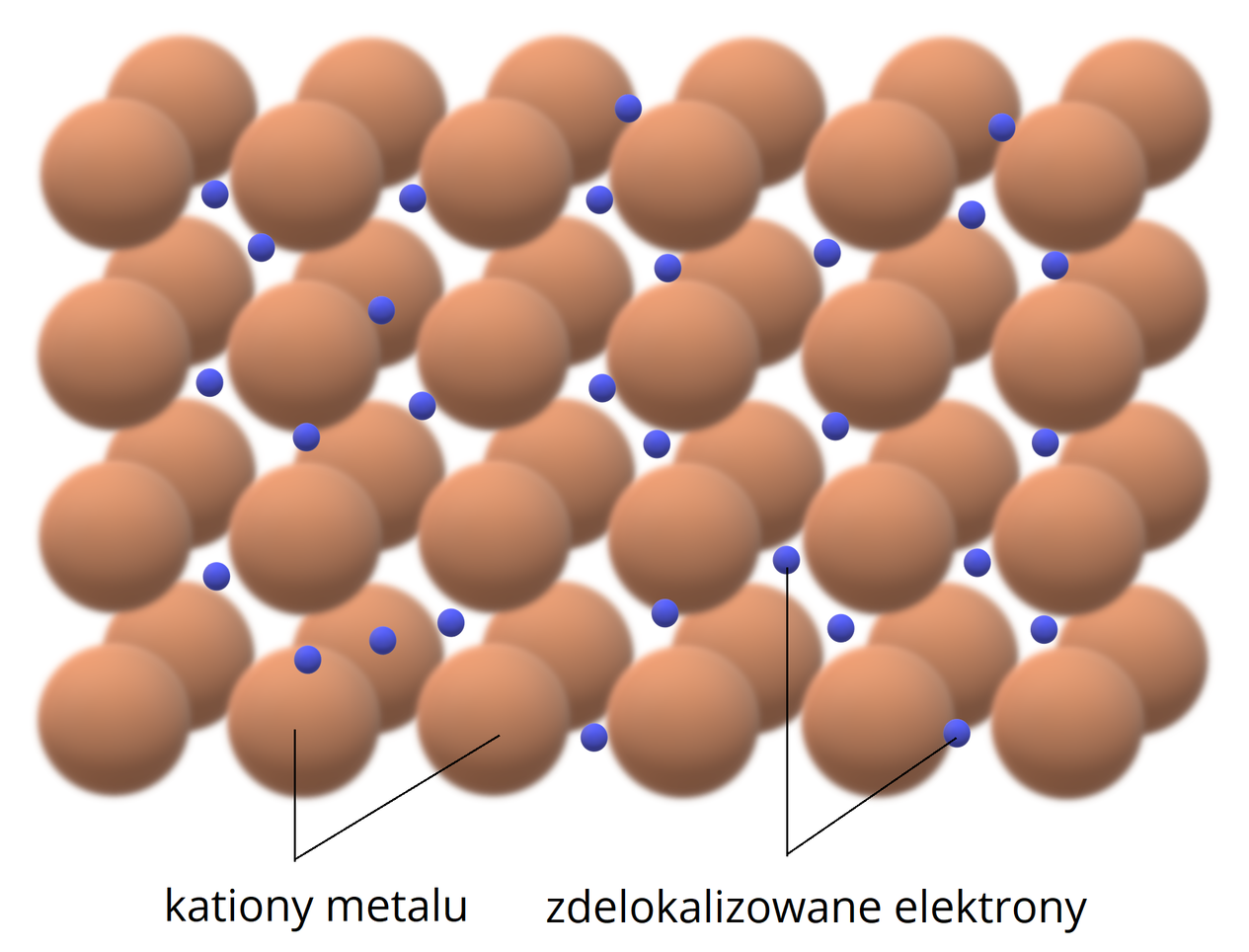
Grafika: Model sieci krystalicznej atomów metalu, z uwzględnieniem zdelokalizowanych elektronów*.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
 Nurtuje Cię pytanie Co to jest wiązanie metaliczne?* Obejrzyj animacje, może uzyskasz odpowiedź.
Nurtuje Cię pytanie Co to jest wiązanie metaliczne?* Obejrzyj animacje, może uzyskasz odpowiedź.
_________________Animacja: Co to jest wiązanie metaliczne?*. Źródło: GroMar Sp. z o.o., Małgorzata Ambroziak, licencja: CC BY-SA 3.0.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

7. Wiązania chemiczne a właściwości substancji

8. Wiązanie wodorowe
 Nurtuje Cię pytanie dotyczące wiązania wodorowego*? Obejrzyj film, może uzyskasz odpowiedź.
Nurtuje Cię pytanie dotyczące wiązania wodorowego*? Obejrzyj film, może uzyskasz odpowiedź.
Film: Wiązania wodorowe*. Źródło: GroMar Sp. z o.o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
Wiązanie wodorowe
- oddziaływanie donor – akceptor, w które zaangażowany jest atom wodoru D–H···A,
- słabe oddziaływanie elektrostatyczne (linia przerywana) między atomem wodoru, związanym kowalencyjnie (linia ciągła) z atomem o dużej elektroujemności (D) i wolną parą elektronową atomu silnie elektroujemnego (A) np. fluoru, tlenu, chloru, azotu, należącego do innej drobiny,
- ma charakter kierunkowy, jądra atomów D–H···A leżą najczęściej wzdłuż linii prostej,
- energia uwalniana podczas tworzenia wiązania wodorowego jest zwykle o rząd wielkości niższa od energii uwalnianej podczas tworzenia typowych wiązań kowalencyjnych,
- określane jako słabe wiązanie, jednak jest niezwykle ważnym elementem struktury wielu substancji, w znacznym stopniu warunkującym ich właściwości,
- liczba wiązań wodorowych tworzonych przez atom donora (D) nie może być większa od liczby wolnych par elektronowych tego atomu.
Warunki konieczne istnienia wiązania wodorowego:
- duże wartości elektroujemności D i A,
- istnienie w akceptorze wolnej pary elektronowej lub polaryzowalnych π - elektronów.
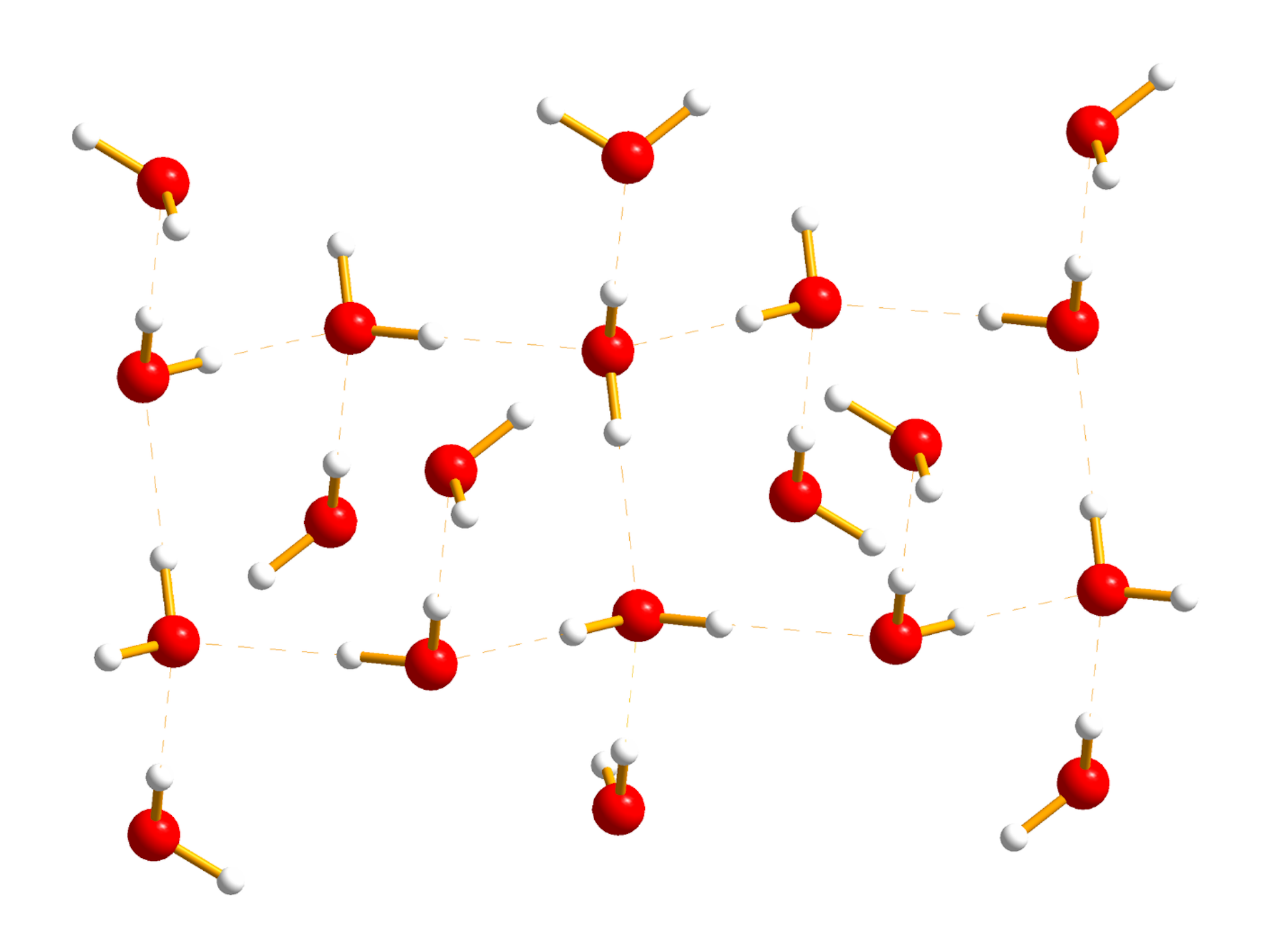
Grafika: Sieć wiązań wodorowych między cząsteczkami wody*.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
 Zastanawiałeś się kiedyś Dlaczego woda wykazuje niezwykłe właściwości?* Obejrzyj film, może uzyskasz odpowiedź.
Zastanawiałeś się kiedyś Dlaczego woda wykazuje niezwykłe właściwości?* Obejrzyj film, może uzyskasz odpowiedź.
Film: Dlaczego woda wykazuje niezwykłe właściwości?*. Źródło: GroMar Sp. z o.o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

9. Jak rozpoznać z jakim rodzajem wiazania chemicznego mamy do czynienia?
 Nurtuje Cię pytanie Jak rozpoznać rodzaj wiązania chemicznego?*. Obejrzyj film, może uzyskasz odpowiedź.
Nurtuje Cię pytanie Jak rozpoznać rodzaj wiązania chemicznego?*. Obejrzyj film, może uzyskasz odpowiedź.
Film: Jak rozpoznać rodzaj wiązania chemicznego?*_________________
Źródło: GroMar Sp. z o.o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0..
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

10. Bibliografia
Adam Bielański, Podstawy chemii nieorganicznej. Warszawa : Wydawnictwo Naukowe PWN, 2013.
Robert Gill, Chemical Fundamentals of Geology and Environmental Geoscience. Sussex : Wiley-Blackwell, 2015.
Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.
Dariusz Witowski, Jan S. Witowski, Chemia - zbiór zadań wraz z odpowiedziami - tom 1-4 (2002-2019) dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii. Łańcut : Oficyna Wydawnicza "Nowa Matura".
Ikona (źródło): Reshot
