Stechiometria wzorów chemicznych i reakcji chemicznych
| Strona: | Open AGH - Otwarte Zasoby Edukacyjne |
| Kurs: | Elementy chemii nieorganicznej dla geologów |
| Książka: | Stechiometria wzorów chemicznych i reakcji chemicznych |
| Wydrukowane przez użytkownika: | Gość |
| Data: | czwartek, 29 stycznia 2026, 15:51 |
1. Stechiometria
Stechiometria to dział chemii określający stosunki ilościowe między składnikami związków chemicznych oraz między reagentami w reakcjach chemicznych.

2. Prawa stechiometryczne
Podstawą obliczeń stechiometrycznych jest znajomość praw stechiometrycznych:
- prawo zachowania masy,
- prawo stałości składu,
- prawo stosunków objętościowych,
- prawo działania mas.
2.1. Prawo zachowania masy
Antonie Lavoisier (1789):
Łączna masa reagentów nie ulega zmianie podczas reakcji chemicznej.
Źródło: Oficyna Pazdro, Reakcja magnezu z bromem kontrolowana za pomocą wagi laboratoryjnej: Doświadczenie 6.11, 02.11.2017[dostęp: 21.04.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=qzq9Ay4paaw.
2.2. Prawo stałości składu (prawo stosunków stałych)
Skład procentowy związku
chemicznego to wykaz zawartości procentowych poszczególnych pierwiastków wchodzących w skład tego związku.
Zawartość procentowa pierwiastka (%E) to wyrażony w procentach stosunek masy tego pierwiastka (mE) w danej próbce do masy całej próbki (m):
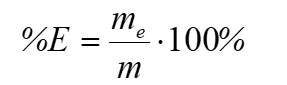
Stosunek masy pierwiastków w związku chemicznym jest wielkością stałą i charakterystyczną dla danego związku.
Stosunek mas pierwiastków jakie wchodzą w skład związku chemicznego jest wartością stałą, niezależną od warunków powstawania tego związku, ani o miejsca jego pochodzenia.
Stosunkowo nieliczne wyjątki zwane bertolidami lub związkami niestechiometrycznymi, dotyczą niektórych substancji w stanie stałym.
2.3. Prawo stosunków objętościowych
Jeżeli wszystkie objętości mierzono w tych samych warunkach ciśnienia i temperatury, to stosunek objętości reagujących gazów i gazowych produktów reakcji jest określony niewielkimi liczbami całkowitymi.
2.4. Prawo działania mas
3. Liczność materii
Miarą liczebności materii jest mol, czyli ilość substancji, która zawiera taką liczbę atomów, cząsteczek, jonów bądź innych cząsteczek materialnych, ile atomów znajduje się w 12 g węgla 12C.
- jedną z siedmiu wielkości podstawowych, niedefiniowanych w układzie SI,
- miarą ziarnistości materii, czyli liczby zawartych w niej drobin lub jednostek formalnych w przypadku substancji jonowych.
(drobin lub ich zdefiniowanych zespołów np. jednostek formalnych, par jonów; ale również cząstek subatomowych, fotonów i innych).
Ilość ta nosi nazwę liczby Avogadra i jest oznaczana literą Na.
Oprócz liczby Avogarda w fizyce i chemii stosuje się też termin stała Avogadra, która różni się od liczby Avogadra jednostką. Liczba Avogadra jest wielkością bezwymiarową, a stała Avogadra to 6.02 · 1023 mol-1 (na mol) .
 Nurtuj Cię pytanie Dlaczego chemicy używają pojęcia mol? Obejrzyj film, może uzyskasz odpowiedź.
Nurtuj Cię pytanie Dlaczego chemicy używają pojęcia mol? Obejrzyj film, może uzyskasz odpowiedź.
_________________Film: Ustalanie wzorów rzeczywistych i empirycznych – ćwiczenia*. Źródło: LEARNETIC SA, licencja: CC BY-SA 4.0.
* Materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.
3.1. Masa mola i objętość mola
Korzystając z poniższych wzorów można ustalić ile wynosi masa jednego mola obiektów mikroświata.
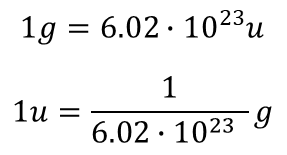
Przeanalizujmy przykład:
Ile wynosi masa jednego mola cząsteczek amoniaku o wzorze NH3?
Masa mola cząsteczek jest iloczynem masy pojedynczej cząsteczki i liczby cząsteczek w mol.
![]()
Masa
mola substancji wyrażona w gramach jest równa liczbowo masie atomowej lub
cząsteczkowej.
Objętość mola zależy od gęstości substancji:
![]()
3.2. Masa molowa i objętość molowa
Masą jednego mola atomów, cząsteczek, jonów bądź innych cząstek materialnych wyrażoną w gramach nazywa się masą molową danej substancji. Jest ona oznaczana dużą literą M i wyrażana w g · mol-1.
Ponieważ liczba atomów, cząsteczek, jonów bądź innych cząstek materialnych zawarta w jednym molu dowolnej substancji jest równa liczbie Avogadra:
Na = 6,023 * 1023
Istnieje zależność:
M = Na · m
gdzie: M - oznacza masę molową, a m bezwzględną masę atomu, cząsteczki, jonu bądź innej cząstki materialnej.
Wartość liczbowa masy molowej w g · mol-1 równa się wartości liczbowej względnej masy atomowej pierwiastka lub względnej masy cząsteczkowej związku albo wartości liczbowej względnej masy cząsteczkowej wynikającej ze wzoru sumarycznego związku chemicznego.
Obejrzyj film Obliczenia mas molowych związków chemicznych, a zobaczysz jak w praktyce można obliczyć masę molową.
Film: Obliczenia mas molowych związków chemicznych*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
_________________
* Materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.

3.3. Zasada Avogadro i równanie Clapeyrona
W równych objętościach różnych gazów znajduje się taka sama liczba drobin pod warunkiem, że ciśnienie i temperatura tych gazów są identyczne
Mol każdego gazu zajmuje taką samą objętość w danych warunkach ciśnienia i temperatury.
Równanie Clapeyrona (równanie stanu gazu doskonałego)
p∙V=n∙R∙T
p – ciśnienie, V – objętość, n –
liczność materii, R – stała gazowa (R=8.31Pa·m3·mol-1·K-1),
T – temperatura termodynamiczna [K]
Objętość 1 mola gazu w warunkach normalnych to 22.4 dm3 (warunki normalne, temperatura 0°C, ciśnienie 1013hPa).
Objętość 1 mola gazu w warunkach standardowych to 24.8 dm3 (warunki standardowe, temperatura 25°C, ciśnienie 1000hPa).

4. Stechiometria wzoru chemicznego
Na podstawie wzoru chemicznego możemy ustalić wzajemne proporcje wagowe pierwiastków tworzących dany związek, wyrażane najczęściej przez udział masowy (nazywany również udziałem wagowym) składnika (pierwiastka) danego związku chemicznego lub przez skład procentowy masowy (wagowy), który jest po prostu udziałem masowym danego składnika pomnożonym przez 100.
Stosunki stechiometryczne
Stosunek stechiometryczny składników związku chemicznego jest to stosunek ilościowy składników w danym związku chemicznym i można go przedstawić następująco:
- stosunek atomowy np. dla N2O5 \( \frac{N}{O} = \frac{2}{5} \)
- stosunek molowy np. dla N2O5 \( \frac{N}{O} = \frac{2 mol}{5 mol} \)
- stosunek masowy np. dla N2O5 \( \frac{N}{O} = \frac{2 \cdot14 u }{5 \cdot16 u } = \frac{28 u }{80 u} =\frac{7}{40} \)
- stosunek procentowy np. dla N2O5 %N=25.9% i %O=74.1%
Jak obliczamy procentową zawartość pierwiastka w związku chemicznym?
Skorzystaj ze wzoru

Grafika: Wzór na obliczenie zawartości procentowej danego pierwiastka w związku chemicznym*.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
* Materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.
4.1. Wzór elementarny i wzór rzeczywisty
Wzór elementarny (empiryczny, najprostszy) – wzór, w którym indeksy stechiometryczne pozostają w stosunku możliwie najmniejszych liczb całkowitych.
Wzór rzeczywisty – ustalamy znając wzór elementarny i masę cząsteczkową związku, jest to wzór sumaryczny, określający faktyczne liczby atomów w cząsteczce danego związku chemicznego.
Obejrzyj film Ustalanie wzorów rzeczywistych i empirycznych – ćwiczenia, a zobaczysz jak w praktyce można ustalić wzór rzeczywisty i empiryczny związku chemicznego.
Film: Ustalanie wzorów rzeczywistych i empirycznych – ćwiczenia*. Źródło: GroMar Sp. z o.o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
_________________
* Materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.
5. Reakcje chemiczne i stechiometria równań reakcji chemicznych
Przemiana fizyczna a przemiana chemiczna

Grafika: Zjawisko fizyczne a przemiana chemiczna*. Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.
Reakcje chemiczne to procesy, w czasie których substancje reagujące ze sobą ulegają przemianom, prowadzącym do powstawania nowych substancji o odmiennych własnościach fizycznych i chemicznych. Reakcje chemiczne zapisuje się w sposób skrócony równaniem reakcji. Równania podają rodzaje i ilości substancji reagujących (substratów) oraz substancji powstających w wyniku reakcji (produktów)
Sposób zapisu reakcji chemicznych:
- słownie (np. dwie dwuatomowe czasteczki wodoru reagują z jedną dwuatomową czasteczką tlenu, tworząc dwie cząsteczki wody)
- za pomocą symboli: 2H2 + O2→ 2 H2O
- graficznie

Grafika: Poprawnie uzgodnione równanie reakcji chemicznej*. Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.
Typy reakcji chemicznych
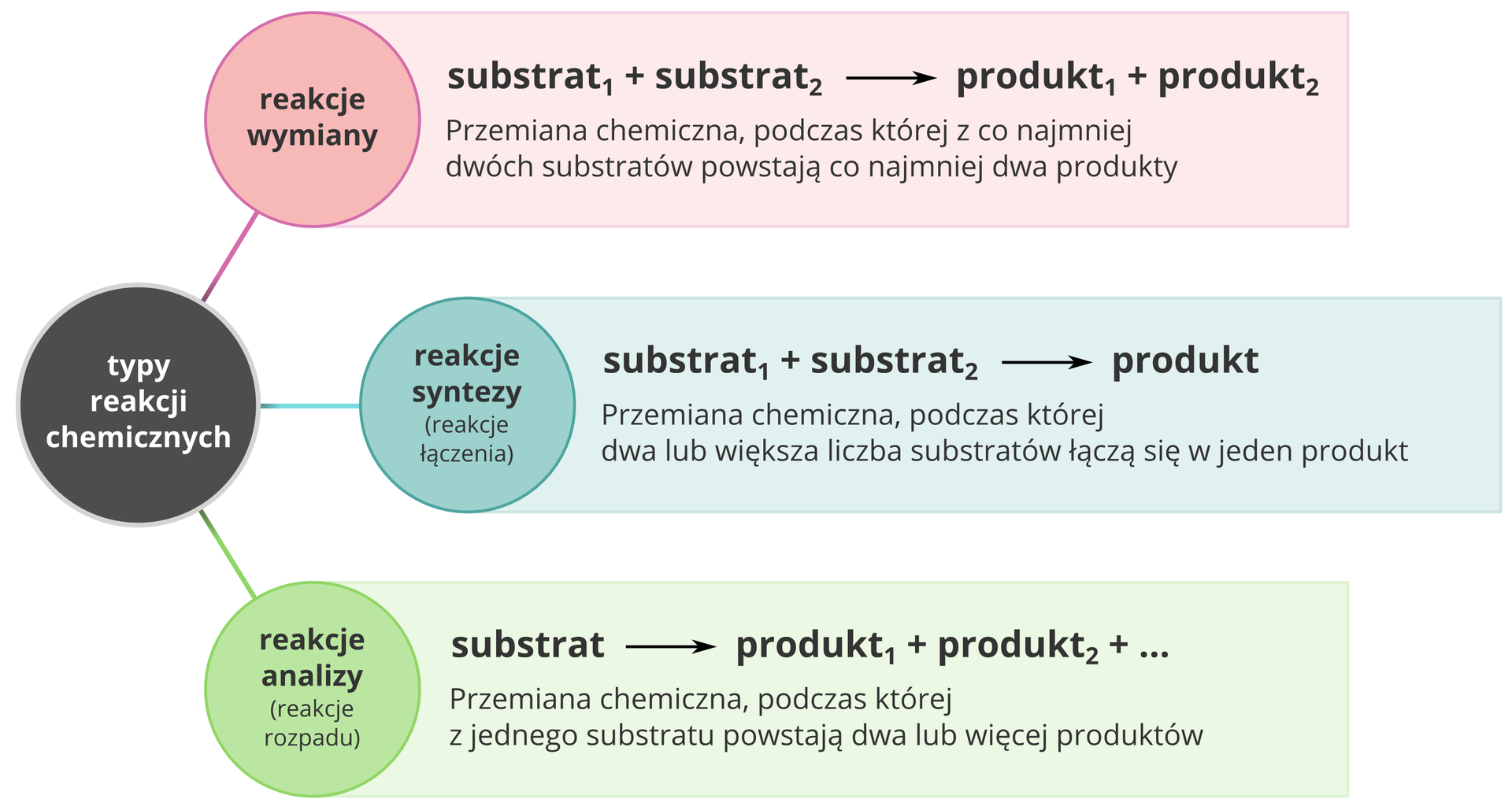
Grafika: Typy reakcji chemicznych*. Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.
Inne kryteria podziału reakcji chemicznych
Ze względu na wystąpienie efektu energetycznego:

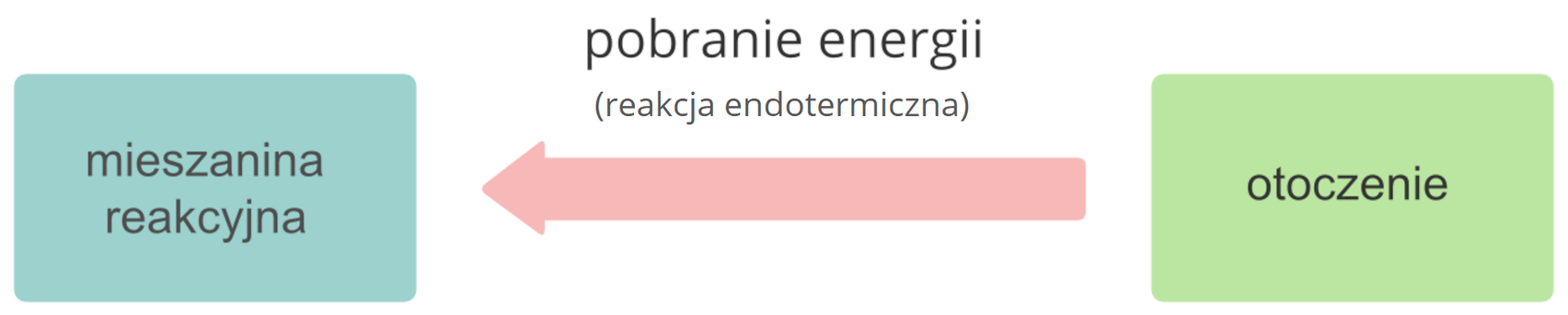
Grafika: Reakcje egzo- i endotermiczne*. Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.
W zależności od ilości faz, w których występują reagenty reakcje chemiczne dzielimy na:
- homogeniczne,
- heterogeniczne.
W zależności czy reakcja jest odwracalna, czy nieodwracalna:
- reakcje chemiczne, które dobiegają do końca, aż do całkowitego zużycia się któregoś z substratów, nazywamy reakcjami nieodwracalnymi lub jednokierunkowymi, np. reakcje spalania lub wydzielania się osadu.
- reakcje odwracalne natomiast mogą przebiegać zarówno w jednym, jak i w przeciwnym kierunku według tego samego równania. Reakcja odwracalna w żadnym kierunku nie przebiega do końca, powstające produkty reagują ze sobą i zmieniają się z powrotem w substraty. Między substratami i produktami ustala się stan równowagi dynamicznej.
Podstawą do wykonania obliczeń stechiometrycznych jest znajomość przebiegu reakcji chemicznej – w najprostszym przypadku – znajomość równania reakcji.
5.1. Stechiometria równań chemicznych
Stosunek stechiometryczny reagentów
Stosunki ilościowe między reagentami (stosunki stechiometryczne reagentów), oblicza się na podstawie równania przebiegu reakcji chemicznej, ponieważ substancje reagują ze sobą w ściśle określonym stosunku ilościowym, charakterystycznym dla danej reakcji. Jak również powstające produkty pozostają do siebie i do substratów w ściśle określonych stosunkach.
Stechiometria pozwala na obliczenie ilości substratów potrzebnych do otrzymania pożądanej ilości produktów reakcji oraz ilości produktów, którą można otrzymać z określonych ilości substratów.
Masowy
stosunek stechiometryczny reagentów
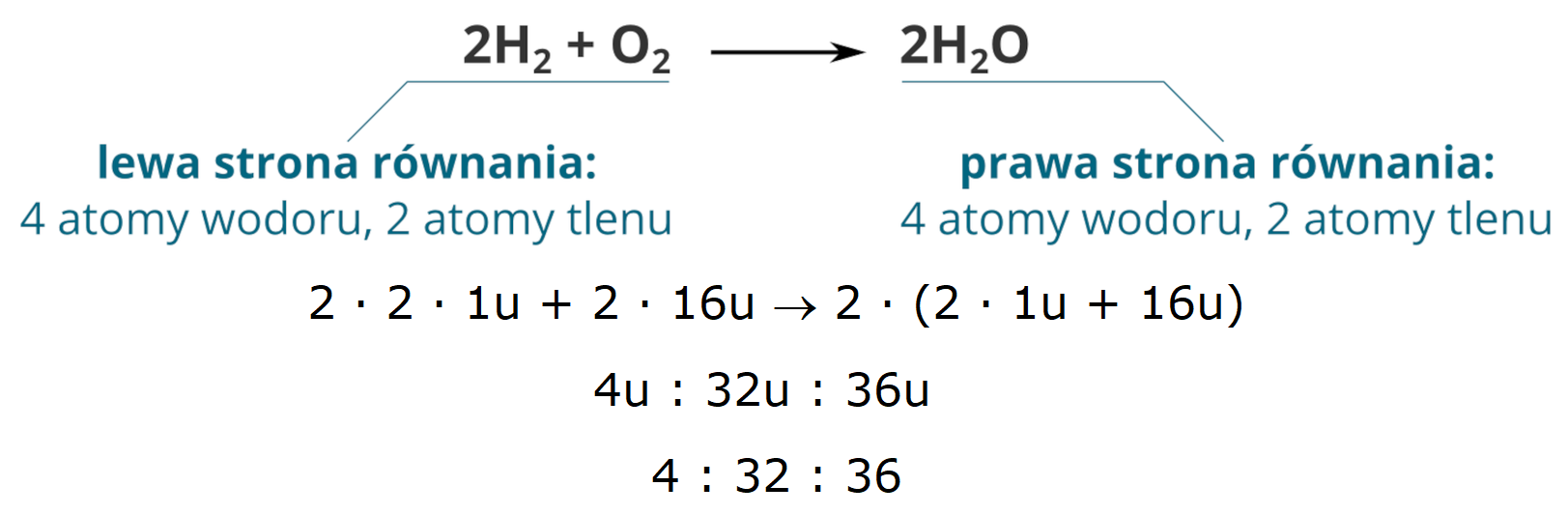
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Poprawnie uzgodnione równanie reakcji chemicznej*.
Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.].
Molowy stosunek stechiometryczny reagentów
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Poprawnie uzgodnione równanie reakcji chemicznej*.
Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.]
Objętościowy
stosunek stechiometryczny reagentów
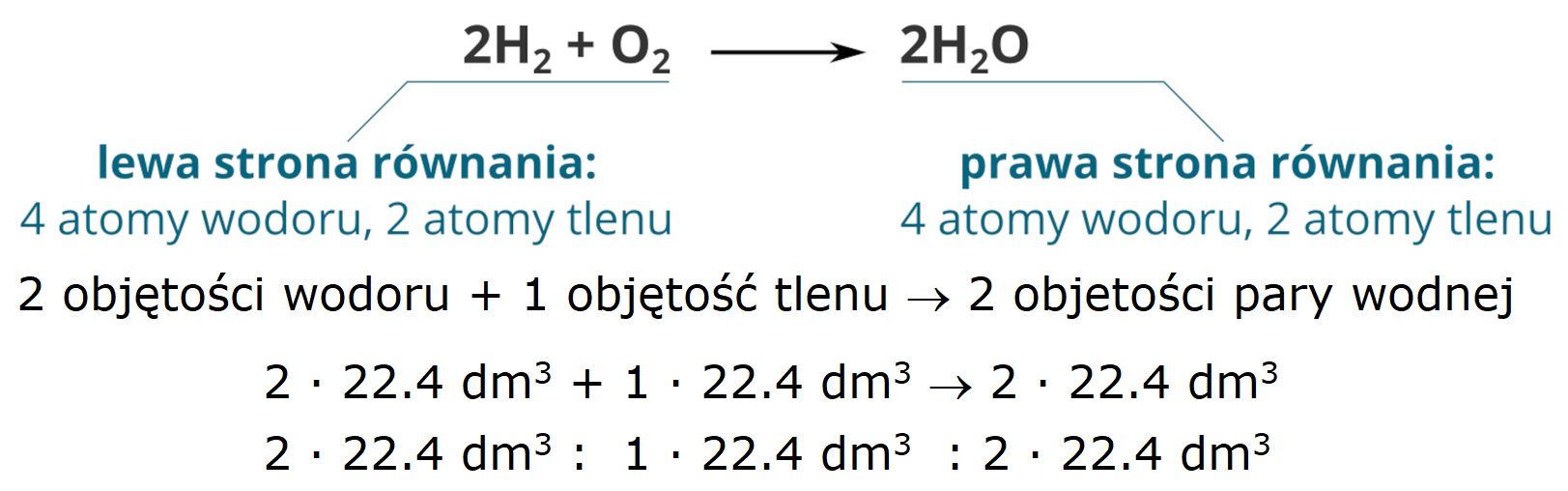
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Poprawnie uzgodnione równanie reakcji chemicznej*.
Źródło: Krzysztof Jaworski, epodreczniki.pl, licencja: CC BY-SA 3.0.]
Słuszne jedynie gdy objętości są odniesione do takich samych warunków ciśnienia i temperatury.
Liczby określające molowy i objętościowy stosunek stechiometryczny reagentów gazowych są równe współczynnikom stechiometrycznym równania chemicznego.
Ilość jednego reagenta określa ilość wszystkich pozostałych reagentów.
5.2. Przebieg reakcji po zmieszaniu substratów w stosunku niestechiometrycznym
W
przypadku zmieszania reagentów w stosunku niestechiometrycznym reakcja może
przebiegać tylko do momentu wyczerpania się jednego reagenta i w konsekwencji ten reagent
decyduje o ilości powstających produktów.
6. Bibliografia
Adam Bielański, Podstawy chemii nieorganicznej. Warszawa : Wydawnictwo Naukowe PWN, 2013.
Robert Gill, Chemical Fundamentals of Geology and Environmental Geoscience. Sussex : Wiley-Blackwell, 2015.
Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.
Dariusz Witowski, Jan S. Witowski, Chemia - zbiór zadań wraz z odpowiedziami - tom 1-4 (2002-2019) dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii. Łańcut : Oficyna Wydawnicza "Nowa Matura".