Tlenki, wodorotlenki, kwasy i sole w naukach o Ziemi i środowisku
| Strona: | Open AGH - Otwarte Zasoby Edukacyjne |
| Kurs: | Elementy chemii nieorganicznej dla geologów |
| Książka: | Tlenki, wodorotlenki, kwasy i sole w naukach o Ziemi i środowisku |
| Wydrukowane przez użytkownika: | Gość |
| Data: | czwartek, 25 grudnia 2025, 04:55 |
1. Podstawowe grupy związków nieorganicznych
Związki nieorganiczne, dawniej określane mineralnymi, to przede wszystkim związki niezawierające węgla. Przy czym należy w tej grupie uwzględnić tlenki węgla (np. CO, CO2), węglany (np. CaCO3), węgliki (np. CaC2, Al4C3), cyjanki (np. KCN) i inne sole.
Ogólny podział związków nieorganicznych zakłada, iż w grupie tej wyróżniamy tlenki, wodorki, wodorotlenki, kwasy, sole i pozostałe substancje, dla których nie można utworzyć oddzielnej klasy ze względu na brak cech wspólnych.

*pozostałe: halogenki azotowców i siarkowców , wiązki międzyfluorowcowe, inne związki niemetali z niemetalami.
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014]
2. Tlenki
Związki pierwiastków (metali i niemetali) z tlenem, gdzie tlen występuje na –II stopniu utlenienia
EnOm
E – symbol
danego pierwiastka, m –
wartościowość pierwiastka E.
Podział

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa: Oficyna Edukacyjna Krzysztof Pazdro, 2014.].
Nazwy
Nazwy tlenków można tworzyć systemem przedrostków, i w tym przypadku zaleca się stosowanie przedrostków o charakterze internacjonalnym (mono, di, tri) lub systemem Stocka. W systemie Stocka nazwę tlenku tworzy się, dodając do słowa tlenek nazwę pierwiastka, np. tlenek sodu. A jeżeli dany pierwiastek tworzy kilka tlenków, w którym przyjmuje różne stopnie utlenienia, to obok nazwy pierwiastka w nawiasie okrągłym zapisujemy jego stopień utlenienia.
Tlenki proste

Tlenki mieszane
Fe3O4 – tlenek żelaza(II, III) → magnetyt
Pb2O3 – tlenek ołowiu(II, IV)
Pb3O4 – tlenek ołowiu(II, IV)
Reakcje prowadzące do otrzymania tlenków
- Bezpośrednia synteza z pierwiastków
S + O2→ SO2
Źródło: Oficyna Pazdro, Reakcja spalania siarki w tlenie: Doświadczenie 4.3. ZP i 3.1. ZR, 02.10.2020
[dostęp: 20.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=51p45KXoBAU.
2 Mg + O2 → 2 MgO
C + O2 → CO2
Źródło: Oficyna Pazdro, Reakcja magnezu z tlenem oraz reakcja węgla z tlenem: Doświadczenie 6.4, 10.11.2017 [dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=GK8ujc_LRB0.
2 S + 3 O2 → 2 SO3 (w obecności katalizatora np. Pt)
2 Fe + O2 → 2 FeO
4 Fe + 3 O2 → 2 Fe2O3
3 Fe + 2 O2 → Fe3O4
Źródło: Oficyna Pazdro, Spalanie żelaza w tlenie: Doświadczenie 5.7, 02.10.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=AS75i8uQZyM.
- Utlenianie lub redukcja innych tlenków
2 SO2 + O2 → 2 SO3 CO2 + C → 2 CO
- Rozkład termiczny
CaCO3→ CaO + CO2
Źródło: Oficyna Pazdro, Rozkład termiczny węglanu wapnia:Doświadczenie 8.12 , 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=vsV22yAm_og.
- Rozkład wyższych tlenków
2 N2O5 → 4 NO2 + O2
- Rozkład soli
MgSO3→ MgO + SO2
- Rozkład wodorotlenków
Fe(OH)2 → FeO + H2O
Budowa i właściwości fizyczne
Tlenki metali mają budowę jonową, są ciałami stałymi o znacznej gęstości, często są barwne, w wodzie praktycznie nierozpuszczalne, ale mogą z wodą reagować (tlenki litowców roztwarzają się w wodzie).
Tlenki niemetali to substancje o wiązaniach kowalencyjnych, występujące w różnych stanach skupienia (ciała stałe, np. P4O10, ciecze np. H2O, lub gazy CO i CO2) w warunkach normalnych.
Właściwości chemiczne
- Tlenki metali I i II grupy układu okresowego reagują z wodą tworząc wodorotlenki – TLENKI ZASADOTWÓRCZE
Na2O+ H2O → 2 NaOH MgO + H2O → Mg(OH)2
- Prawie wszystkie tlenki niemetali reagują z wodą tworząc kwasy – TLENKI KWASOTWÓRCZE (bezwodniki kwasowe)
N2O5+ H2O → 2 HNO3 SO3 + H2O → H2SO4 CO2 + H2O → H2CO3 *
* ponieważ kwas węglowy jest kwasem nietrwałym za bardziej poprawny uważa się zapis wzoru w postaci H2O · CO2
- Nietrwałe tlenki pod wpływem ogrzewania rozkładają się do pierwiastków lub niższych tlenków
2 HgO → 2 Hg + O2
Źródło: Oficyna Pazdro, Rozkład tlenku rtęci(II):
Doświadczenie 6.6 , 10.11.2017 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=8YUP1KbNFjE.
- Niższe tlenki mogą utleniać się do wyższych tlenków
2 SO2 + O2 → 2 SO3
- Większość tlenków metali reaguje z kwasami, tworząc sole - TLENKI ZASADOWE
MgO + 2 HCl → MgCl2 + H2O
- Większość tlenków niemetali reaguje z zasadami, tworząc sole - TLENKI KWASOWE
Ca(OH)2 + CO2 → CaCO3 + H2O
Zdolność do reakcji z kwasami i zasadami pozwala podzielić tlenki na 4 kategorie wskazane powyżej: tlenki kwasowe, zasadowe, amfoteryczne* i obojętne
Obejrzyj film Klasyfikacja tlenków ze względu na reaktywność względem wody, kwasów i zasad oraz formy zapisu równań reakcji chemicznych.
Film: Klasyfikacja tlenków ze względu na reaktywność względem wody, kwasów i zasad oraz formy zapisu równań reakcji chemicznych**. Źródło: Barbara Rolka, GroMar Sp. z o.o., licencja: CC BY-SA 3.0.

Pomiędzy położeniem pierwiastka w układzie okresowym, a charakterem chemicznym tlenku zachodzą następujące zależności:
- Tlenki zasadowe to tlenki metali.
- Tlenki kwasowe to tlenki niemetali oraz tlenki pierwiastków bloku d na wysokich stopniach utlenienia.
- W okresie następuje stopniowe przejście charakteru tlenków – od zasadowego poprzez amfoteryczny, aż do kwasowego.
- W obrębie grupy, w miarę wzrostu liczby atomowej, rośnie reaktywność tlenków zasadowych, a maleje reaktywność tlenków kwasowych.

Jeśli masz wątpliwość jaki charakter chemiczny mają interesujące Cię tlenki odwiedź stronę Jaki charakter mogą mieć tlenki?
Grafika interaktywna: Jaki charakter mogą mieć tlenki?* Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
***Przykładowe reakcje tlenków amfoterycznych
Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O
Al2O3 + 6 KOH→2 K3AlO3 + 3 H2O lub Al2O3 + 2 KOH + 3H2O → 2 K[Al(OH)4]
ZnO
+ 2 HCl
→ ZnCl2
+ H2O
ZnO + 2 NaOH → Na2ZnO2 + H2O lub ZnO + 2NaOH + H₂O → Na₂[Zn(OH)₄]
_________________
** Materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot
3. Wodorki
Wzór ogólny wodorków można przedstawić w postaci EHn jeśli pierwiastek E leży w grupie od 1 do 15, lub HnE jeśli należy do grupy 16 lub 17.
Podział

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0[na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.].
Nazwy
Nazwy wodorków o wzorze EHn tworzy się dodając do wyrazu wodorek nazwę pierwiastka E, np.: wodorek sodu. W przypadku wodorków typu HnE nazwy są nazwami złożonymi, np.: HBr - bromowodór.
Reakcje prowadzące do otrzymania wodorków
- Bezpośrednia synteza z pierwiastków, ale dla każdego z wodorków reakcja ta przebiega w innych warunkach
H2 + Cl2 → 2 HCl
Źródło: Oficyna Pazdro, Otrzymywanie chlorowodoru i kwasu chlorowodorowego (cz. 1):Doświadczenie 7.6 (cz. 1) , 26.03.2020 [dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=3aR1b_CXY0g.Budowa i właściwości fizyczne
W przypadku wodorków metali w większości przypadków są ciałami stałymi o barwie białej, natomiast wodorki niemetali to gazy.
Większość wodorków metali podczas ogrzewania ulega rozkładowi na metal i wodór.
Właściwości chemiczne
- Wodorki metali w reakcji z wodą dają wodorotlenki
NaH+ H2O → NaOH + H2↑
NaH(s)+ H2O → Na++ OH- + H2↑
- Wodorki niemetali oddziałują z wodą na trzy sposoby:
- bez efektu chemicznego,
- dysocjują na jony tworząc roztwór o charakterze kwasowym (kwasy beztlenowe), np.: HCl → H+ + Cl-,
- z wytworzeniem słabej zasady, np.: NH3 + H2O ↔ NH4+ + OH-.
Źródło: Oficyna Pazdro, Otrzymywanie amoniaku i badanie jego rozpuszczalności w wodzie:Doświadczenie 4 PC2 , 26.05.2020
[dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=3yDReCiFJW4.
4. Wodorotlenki
Związki zawierające atom metalu i jedną lub kilka grup wodorotlenowych o wzorze ogólny
M(OH)m
M – symbol danego metalu, n – liczba grup wodorotlenkowych w cząsteczce wodorotlenku.
Wodorotlenki mają budowę jonową Mn+ n(OH)-, a liczba jonów OH- zależy od stopnia utlenienia metalu, np. NaOH, Ca(OH)2, Fe(OH)3.
Podział

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta –
Chemia. Repetytorium dla przyszłych maturzystów i studentów – wydanie 2014].
Nazwy
Nazwy tworzy się dwoma sposobami: 1) poprzez określenie liczby grup OH przedrostkami odliczebnikowymi i dodanie do nazwy metalu M, np. Fe(OH)2 - diwodorotlenek żelaza; lub 2) dodanie do słowa wodorotlenek nazwy metalu i w nawiasie podanie jego stopnia utlenienia. Zgodnie z umową, jeżeli dany pierwiastek w związkach chemicznych występuje tylko na jednym stopniu utlenienia, to nie jest konieczne podawanie go w nawiasie.
Przykłady
NaOH – wodorotlenek sodu
Ba(OH)2 – wodorotlenek baru
Al(OH)3 – wodorotlenek glinu
Fe(OH)2 – wodorotlenek żelaza(II) – diwodorotlenek żelaza
Fe(OH)3 – wodorotlenek żelaza(III) – triwodorotlenek żelaza
Mn(OH)2 – wodorotlenek manganu(II) – diwodorotlenek manganu
Mn(OH)4 – wodorotlenek manganu(IV) – tetrawodorotlenek manganu
Wodorotlenki
złożone to wodorotlenki zawierające różne metale, np.: Ca3Al2(OH)12.
Hydroksotlenki (oksowodorotolenki) to związki zbudowane z jonów M+, MOnm+, OH-, O2- w różnych kombinacjach, np.: FeO(OH).
Reakcje prowadzące do otrzymania wodorotlenków
Dwie najpopularniejsze z laboratoryjnych metod otrzymywania wodorotlenków przedstawiono na schemacie:
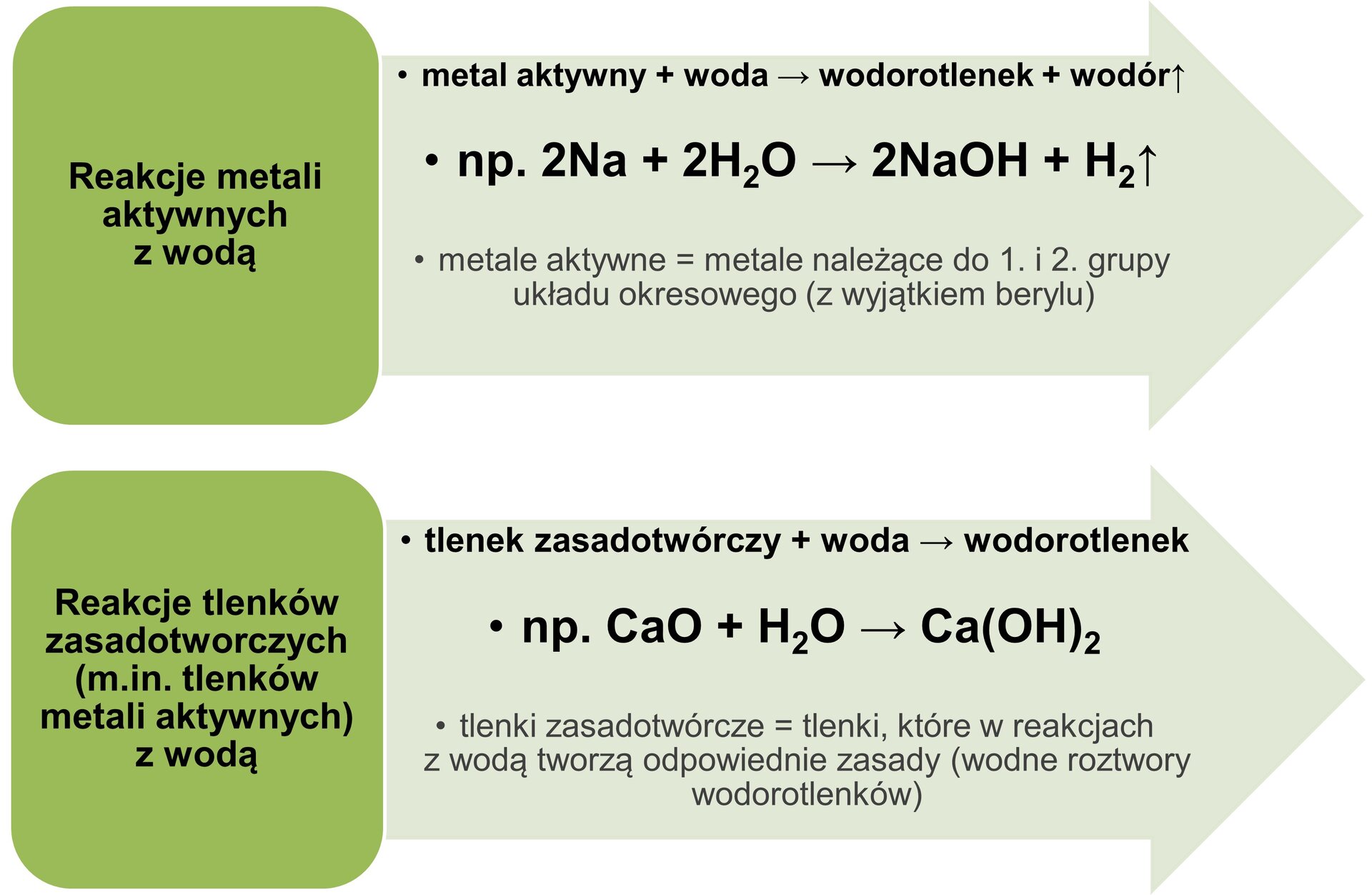
Grafika: Wybrane laboratoryjne metody otrzymywania wodorotlenków*.Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
- Reakcja aktywnego metalu bloku s z wodą
2Na + 2 H2O → 2 NaOH + H2↑
Źródło: Oficyna Pazdro, Reakcja sodu z wodą:Doświadczenie 7.11 , 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=2kefsQGPfo4.
2 K + 2 H2O → 2 KOH + H2↑
Mg + 2 H2O → Mg(OH)2 + H2↑
Ca + 2 H2O → Ca(OH)2 + H2↑
Źródło: Oficyna Pazdro, Badanie przebiegu reakcji metali lekkich z wodą: Doświadczenie 4.1, 02.10.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=f03OhP0tdI0.- Reakcja odpowiedniego tlenku metalu (blok s) z wodą
MgO + H2O → Mg(OH)2
Źródło: Oficyna Pazdro, Otrzymywanie tlenku magnezu i jego reakcja z wodą:Doświadczenie 7.9 , 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=xE1XZ4yZodA.
- Reakcja niektórych soli z innymi wodorotlenkami (reakcja strącania)
FeCl3 + 3 NaOH → Fe(OH)3↓ + 3 NaCl
Źródło: Oficyna Pazdro, Strącanie i roztwarzanie wodorotlenków żelaza: Doświadczenie 8.6, 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=4yLJNWb7FhE.
CuSO4 + 2 NaOH → Cu(OH)2↓ + 3 NaSO4
Źródło: Oficyna Pazdro, Reakcja siarczanu(VI) miedzi(II) z wodorotlenkiem sodu: Doświadczenie 8.5, 26.03.2020 [dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=PD0Mn-d8IYs.
- Reakcje niektórych wodorków z wodą
CaH2 + 2 H2O → Ca(OH)2↓ + 2 H2
Budowa i właściwości fizyczne
Wodorotlenki to ciała stałe o budowie jonowej, często zabarwione, o różnej rozpuszczalności w wodzie. Wodorotlenki litowców są bardzo dobrze rozpuszczalne w wodzie, słabiej rozpuszczalne są wodorotlenki berylowców, podczas gdy prawie wszystkie pozostałe związki tego typu są bardzo słabo rozpuszczalne.
Wodne roztwory niektórych wodorotlenków nazywamy ZASADAMI.
Roztwory zasadowe tworzą te wodorotlenki, które mają dostatecznie dużą rozpuszczalność w wodzie i ulegają w niej rozpadowi na jony, czyli dysocjują
NaOH → Na+ + OH-
Ca(OH)2 → Ca2+ + 2 OH-
Właściwości
takie są charakterystyczne wyłącznie dla wodorotlenków litowców – LiOH, NaOH,
KOH, RbOH, CsOH oraz niektórych berylowców – Ba(OH)2, Sr(OH)2,
Ca(OH)2. W przypadku wodorotlenków słabo rozpuszczalnych w wodzie dysocjują
tylko w niewielkim stopniu, co prowadzi do ustalenia stanu równowagi faza stała
– roztwór.
Moc wodorotlenków rośnie w grupach i maleje w okresach układu okresowego w miarę wzrostu liczby atomowej.
A czy wiesz, że zasadowy charakter cechuje także wodny roztwór amoniaku – NH3 · H2O, i pomimo, że nie istnieje wodorotlenek amonu, w wodnym roztworze tego związku, czyli wodzie amoniakalnej, zachodzi odwracalna reakcja
NH3 + H2O \( \rightleftharpoons \) NH4+ + OH- , a pojawiające się jony wodorotlenkowe są odpowiedzialne za właściwości zasadowe roztworu.
Źródło: Oficyna Pazdro, Otrzymywanie amoniaku i badanie jego rozpuszczalności w wodzie:Doświadczenie 4 PC2 , 26.05.2020
[dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=3yDReCiFJW4.
Właściwości chemiczne
- Reagują z kwasami w wyniku czego powstają sole
NaOH + HCl → NaCl + H2O
LiOH + HBr → LiBr + H2O
- Reagują z tlenkami kwasowymi, tworząc sole
2 Fe(OH)3 + 3 N2O5 → 2 Fe(NO3)3 + 3 H2O
Ca(OH)2 + SO3 → CaSO4 + H2O
- Wodorotlenki metali lekkich reagują z solami metali ciężkich, tworząc słabo rozpuszczalne wodorotlenki tych metali
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2SO4
Na2CO3 + Ca(OH)2 → NaOH + CaCO3↓
- Wodne roztwory mocnych wodorotlenków roztwarzają niektóre metale
2 Al + 6 NaOH + 6 H2O → 2 Na3[Al(OH)6] + 3 H2↑
- Ulegają rozkładowi termicznemu na odpowiedni tlenek i wodę
2 AgOH → Ag2O + H2O
Hg(OH)2 → HgO + H2O
Cu(OH)2 → CuO + H2O
Źródło: Oficyna Pazdro, Otrzymywanie i rozkład termiczny wodorotlenku miedzi(II):Doświadczenie 4.9. ZP i 3.8. ZR , 02.10.2020 [dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=TP0ToUpOz6w.
- Reakcje wymiany dla wodorotlenków o charakterze amfoterycznym
Wodorotlenki amfoteryczne: Al(OH)3, Cr(OH)3, Zn(OH)2, As(OH)3 – reagują zarówno z kwasami jak i z zasadami
Al(OH)3 + 3 HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
Na[Al(OH)4] → NaAlO2 + 2 H2O
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot
5. Kwasy
Właściwości chemiczneZwiązki zbudowane z atomów wodoru i reszty kwasowej o wzorze ogólnym
HnR
n – wartościowość reszty kwasowej R.
Podział
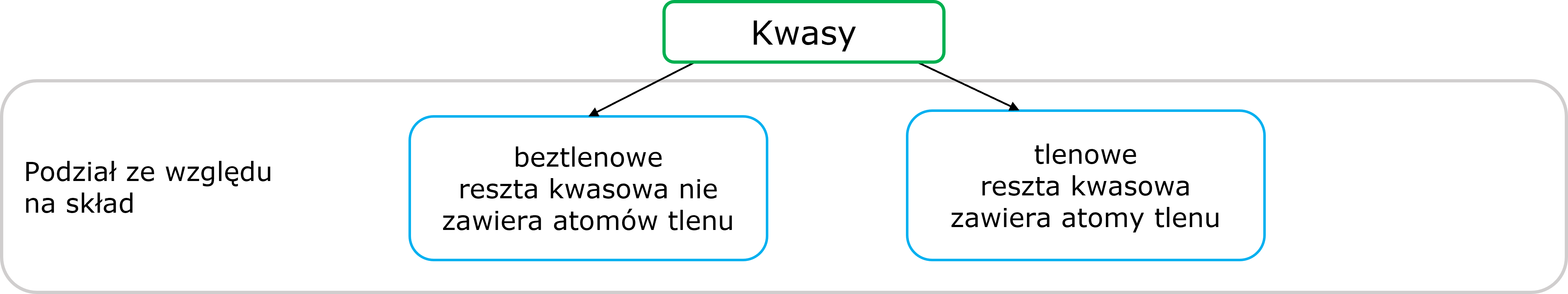
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta –
Chemia. Repetytorium dla przyszłych maturzystów i studentów – wydanie 2014].
Nazwy
Ogólnie nazwy kwasów beztlenowych tworzy się dodając do nazwy pierwiastka tworzącego kwas końcówkę "wodorowy".
- kwas chlorowodorowy, kwas solny HCl(aq)
- kwas fluorowodorowy HF(aq)
- kwas bromowodorowy HBr(aq)
- kwas jodowodorowy HI(aq)
- kwas siarkowodorowy H2S(aq)
Nazwy kwasów tlenowych wywodzą się od nazwy niemetalu z końcówką „-owy”. Jeżeli ten sam pierwiastek tworzy kwasy na różnych stopniach utlenienia, to w nawiasie za nazwą podaje się wartościowość tego niemetalu w danym kwasie. Jest to nomenklatura kwasowa skrócona, usunięta z zaleceń PTChem. Obok podano również nazwy kwasowe systematyczne, w których na końcu podany jest ładunek anionu (reszty kwasowej).
- H2SO3 – kwas siarkowy(IV) – kwas trioksosiarkowy(2-)
- H2SO4 – kwas siarkowy(VI) – kwas tetraoksosiarkowy(2-)
- HNO3 – kwas azotowy(V) – kwas trioksoazotowy(1-)
- HNO2 – kwas azotowy(III) – kwas dioksoazotowy(1-)
- H3PO4 – kwas ortofosforowy(V) – kwas tetraoksofosforowy(3-)
- H2CO3 – kwas węglowy – kwas trioksowęglowy(2-) *
* ponieważ kwas węglowy jest kwasem nietrwałym za bardziej poprawny uważa się zapis wzoru w postaci H2O · CO2.
Dla rozszerzenia i utrwalenia wiedzy obejrzyj film Nomenklatura kwasów.
Film: Nomenklatura kwasów*. Źródło: Piotr Dzwoniarek, GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Reakcje prowadzące do otrzymania kwasów
Poniższy schemat przedstawia dwie spośród metod otrzymywania kwasów.

Grafika: Wybrane laboratoryjne metody otrzymywania kwasów nieorganicznych*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Reakcje prowadzące do otrzymania kwasów beztlenowych
- Rozpuszczanie wodorków niemetali w wodzie
H2 + Cl2 → 2 HCl HCl(gaz) + H2O → HCl(aq)
Źródło: Oficyna Pazdro, Otrzymywanie chlorowodoru i kwasu chlorowodorowego (cz. 1): Doświadczenie 7.6 (cz. 1), 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=3aR1b_CXY0g.
Źródło: Oficyna Pazdro, Otrzymywanie chlorowodoru i kwasu chlorowodorowego (cz. 2): Doświadczenie 7.6 (cz. 2), 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=Od3xKceZAWE.
H2 + S → H2S H2S(gaz) + H2O → H2S(aq)
- Reakcje niektórych niemetali z wodą
Cl2 + H2O → HCl + HClO (podobnie reagują brom i jod)
Reakcje prowadzące do otrzymywania kwasów tlenowych
- Reakcje tlenków niemetali o charakterze kwasowym z woda
N2O5+ H2O → 2 HNO3
SO3 + H2O → H2SO4
P4O10 + 6 H2O → 4 H3PO4
Źródło: Oficyna Pazdro, Spalanie fosforu i otrzymywanie kwasu fosforowego(V): Doświadczenie 7.5, 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=mgD44czTnm0.CO2 + H2O → H2O · CO2
N2O3+ H2O → 2 HNO2
SO2 + H2O → H2SO3
- Strącania
osadu, jeżeli kwas jest słabo rozpuszczalny
H2SO4 + Na2SiO3 → H2SiO3↓ + Na2SO4
- Powstawania słabego elektrolitu, lub nietrwałego kwasu
CaS + HNO3 → Ca(NO3)2 + H2S↑ lub CaCO3 + HCl → CaCl2 + H2O · CO2
Budowa i właściwości fizyczne
Kwasy rozpuszczalne w wodzie są elektrolitami, dysocjują w wodzie na jony H+ i aniony reszty kwasowej.
HCl → H+ + Cl-
H2SO4 → 2 H+ + SO42-
Stężone roztwory kwasów są żrące, a rozcieńczając je należy bezwzględnie przestrzegać zasady "PAMIĘTAJ CHEMIKU MŁODY WLEWAJ ZAWSZE KWAS DO WODY".
Źródło: Oficyna Pazdro, Badanie właściwości kwasu siarkowego(VI): Doświadczenie 7.3, 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=aX3S59anV2I.
Źródło: Oficyna Pazdro, Badanie właściwości kwasu azotowego(V): Doświadczenie 7.4, 26.03.2020 [dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=hbbk1248JYk.
Właściwości chemiczne
- Reakcje kwasowo-zasadowe – reakcje neutralizacji (zobojętniania)
KOH + HCl → KCl + H2O
NaOH + HNO3
→ NaNO3 +
H2O
- Reakcje wymiany w roztworach wodnych, głównie w reakcjach z tlenkami metali i solami
Na2O + HNO3 → NaNO3 + H2O
CuO + 2 HCl → CuCl2 + H2O
Na2CO3 + 2 HNO3 → NaNO3 + H2O + CO2
CaS + 2 HNO3 → Ca(NO3)2 + H2S↑
- Reakcje z metalami
Mg + 2 HCl → MgCl2 + H2↑
Zn + 2 HCl → ZnCl2 + H2↑
Fe + 2 HCl → FeCl2 + H2↑
Źródło: Oficyna Pazdro, Reakcje metali z kwasem solnym: Doświadczenie 7, 26.05.202 [dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=Gj_Dh8vBhiA.
Reakcji takiej nie ulegają metale szlachetne, takie jak złoto, srebro, rtęć czy miedź. Mogą natomiast ulegać reakcjom z kwasami utleniającymi, w reakcjach tych nie wydziela się jednak wodór
Cu + H2SO4 (stężony) → CuSO4 + SO2 + 2 H2O
Cu + 4 HNO3 (stężony) → Cu(NO3)2 + 2 NO2 + 2H2O
Podział na metale aktywne i nieaktywne w reakcji z kwasami ma swoje uzasadnienie w szeregu elektrochemicznym metali.
Grafika: Szereg aktywności metali*. Źródło: epodreczniki.pl, licencja: CC BY-SA 3.0.
Moc kwasów beztlenowych
- rośnie w obrębie okresu od lewej do prawej i maleje w obrębie grupy od dołu do góry.
Moc kwasów tlenowych
- rośnie ze wzrostem elektroujemności centralnego atomu reszty kwasowej, zarówno w okresach jak i w grupach,
- rośnie (poza nielicznymi wyjątkami) ze wzrostem liczby atomów tlenu.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot
6. Sole
Ogólny wzór soli obojętnych to MnRm gdzie M oznacza kation metalu lub grupę amonową, a R to reszta kwasowa, n i m oznaczają współczynniki stechiometryczne odpowiadające ładunkowi kationu metalu (m) i ładunkowi reszty kwasowej (n).
Wodorosole, pochodzą od kwasów wielowodorowych, w których tylko część atomów wodoru jest zastępowana przez metal lub jon amonowy; można je przedstawić ogólnym wzorem: Mn(HkR)m, gdzie n,m,k – współczynniki stechiometryczne.
Hydroksosole, powstają z wodorotlenków wielohydroksylowych, i opisuje je wzór ogólny: Mn(OH)kRm, gdzie n,m,k – współczynniki stechiometryczne.
Sole uwodnione (hydraty) to sole o wzorze ogólnym a MnRm · b H2O, gdzie a oznacza liczbę moli soli, a b - liczbe moli wody.
Sole podwójne to związki chemiczne zawierające dwa rodzaje kationów i jeden rodzaj anionu lub jeden rodzaj kationu i dwa rodzaje anionów.
Obejrzyj film Sole podwójne.
Film: Sole podwójne*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.Podział
Jeden spójny podział soli jest trudny do wypracowania. Poniżej przedstawiono różne próby usystematyzowania tej wiedzy.
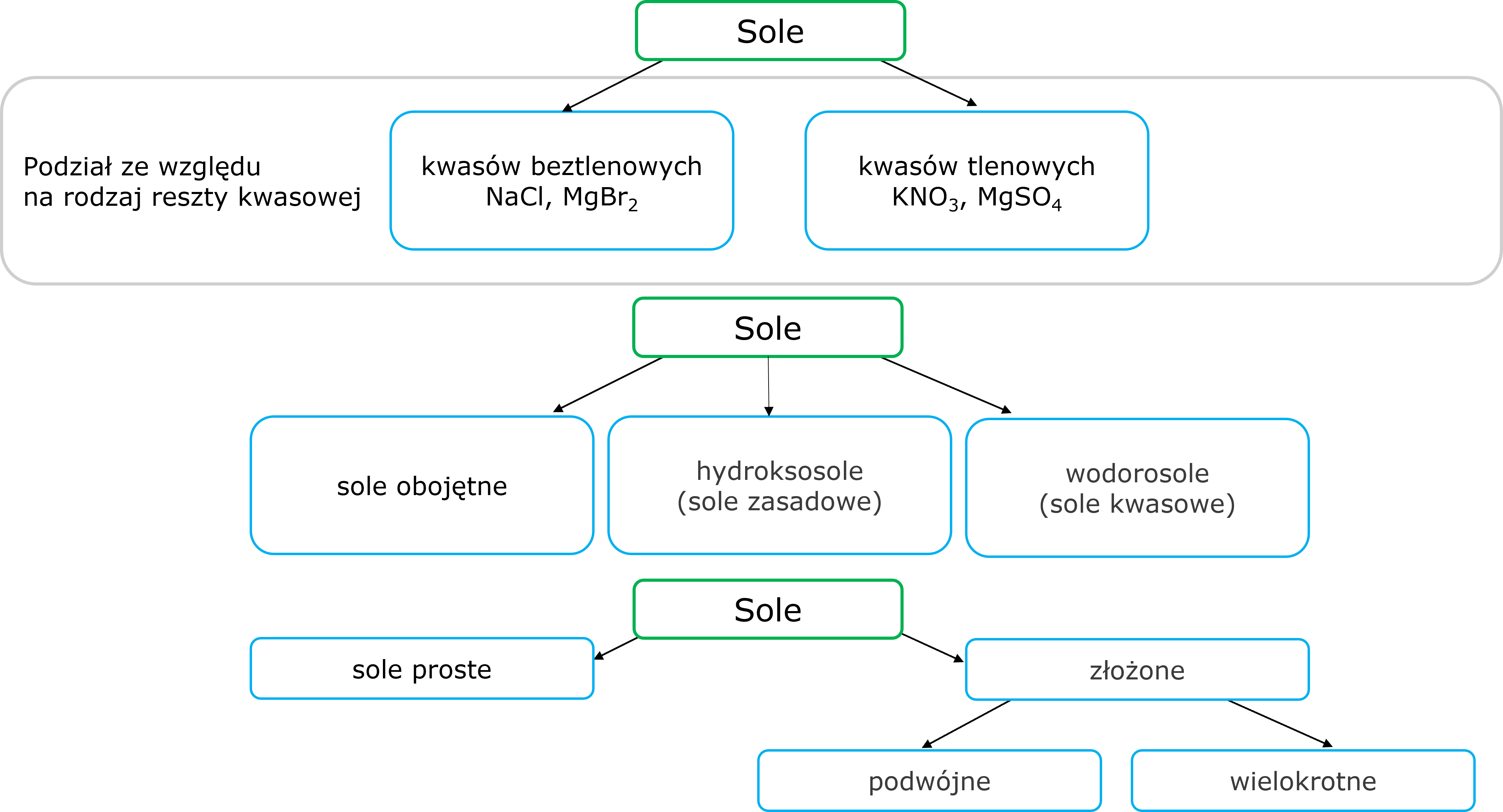
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0 [na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.].
Wśród zaprezentowanych podziałów nie znalazła się nigdzie informacja o solach kompleksowych i hydratach. Należy to uzupełnić, zatem:
Sole kompleksowe to sole, które zwierają w swoim składzie kompleksowy kation i (lub) kompleksowy anion, np.: K4[Fe(CN)6]
Sole uwodnione (hydraty) to sole zawierające w sieci krystalicznej cząsteczki wody, czyli tzw. wodę hydratacyjną (krystalizacyjną), która może zostać uwolniona w procesie dehydratacji (odwodnienia) przebiegajacym zwykle podczas ogrzewania. W tym miejscu należy również zdefiniować proces hydratacji (akwatacji, uwodnienia), przekształacajacy substancje bezwodną w hydrat lub proces tworzenia akwakompleksów albo addycji wody do wiązań wielokrotnych.
Źródło: Oficyna Pazdro, Dehydratacja i hydratacja siarczanu(VI) miedzi(II): Doświadczenie 5.3, 2.10.2020 [dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=TWGX1T5jYRY.
Nazwy
- Nazwy soli prostych i złożonych
Nazwa soli prostej zawiera dwa wyrazy, pierwszy określający anion, a drugi – kation.
Nazwy soli złożonych składają się z tylu wyrazów, ile rodzajów jonów
zawiera sól, przy czym najpierw wymienia się aniony, a następnie kationy,
zachowując porządek alfabetyczny wymienianych jonów w obu grupach. Przedrostki
określające ilość danego rodzaju jonów nie wpływają na kolejność alfabetyczną.
- Nazewnictwo soli kwasów tlenowych
Pierwsza część nazwy soli pochodzi od nazwy kwasu i kończy się na -an np.: sól kwasu siarkowego(VI) to siarczan(VI), sól kwasu azotowego(V) to azotan(V). Druga część nazwy pochodzi od nazwy metalu. Jeśli metal posiada tylko jedną wartościowość to jej nie podajemy. Tak samo jeśli niemetal tworzy tylko jeden kwas to wartościowości niemetalu także nie podajemy. Przykładem może tu być kwas węglowy H2CO3 i jego sole węglany.
Przykłady soli:
MgSO4 - siarczan(VI) magnezu,KNO3 - azotan(V) potasu,
Na3PO4 - fosforan(V) sodu,
FeSO4 - siarczan(VI) żelaza(II),
Sole amonowe kwasów tlenowych
W przypadku soli amonowych zamiast nazwy metalu podajemy przyrostek "amonu".
NH4NO3 - azotan(V) amonu,(NH4)2SO4 - siarczan(VI) amonu.
- Nazewnictwo soli kwasów beztlenowych
Pierwsza część nazwy soli pochodzi od nazwy kwasu i kończy się na -ek. Na przykład sól kwasu chlorowodorowego to chlorek, sól kwasu bromowodorowego to bromek, sól kwasu siarkowodorowego to siarczek. Druga część nazwy pochodzi od nazwy metalu.
Przykłady soli:
NaCl - chlorek
sodu,
FeCl3
- chlorek żelaza(III).
Sole amonowe kwasów beztlenowych
W przypadku soli amonowych zamiast nazwy metalu podajemy przyrostek "amonu". Przykłady:
NH4Cl
- chlorek amonu,
NH4Br
- bromek amonu.
- Nazewnictwo wodorosoli
Nazwy wodorosoli zawierają liczbę atomów wodoru, jakie pozostały przy reszcie kwasowej:
K2HPO4
- wodorofosforan(V) potasu,
KH2PO4
- diwodorofosforan(V) potasu,
KHSO4
- wodorosiaczan(VI) potasu.
- Nazewnictwo hydroksosoli
Dla hydroksosoli podaje się liczbę grup wodorotlenkowych, które pozostały związane z metalem tworzącym sól:
Mg(OH)NO3
- azotan(V) wodorotlenek magnezu,
- Nazewnictwo hydratów
Wzory typu a MnRm · b H2O czyta się następująco, np.:
CaSO4 · 2 H2O – siarczan(VI) wapnia – woda
(1/2),
Na2CO3 · 10 H2O
– węglan sodu – woda (1/10),
2 CdSO4 · 8 H2O siarczan(VI) kadmu – woda (3/8).
Dla rozszerzenia i utrwalenia wiedzy obejrzyj film Nomenklatura i wzory hydratów.
Film: Nomenklatura i wzory hydratów*. Źródło: Patrycja Męcik, GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Reakcje prowadzące do otrzymania soli
- Reakcje bezpośredniej syntezy z metalu i niemetalu (tylko sole kwasów beztlenowych)
2 Fe + 3 Cl2 → 2 FeCl3
Źródło: Oficyna Pazdro, Reakcja żelaza z chlorem: Doświadczenie 4.14, 2.10.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=6p_2ojrWOiM.
2 Al + 3 S → Al2S3
Źródło: Oficyna Pazdro, Synteza siarczku glinu Al2S3 z glinu i siarki: Doświadczenie 3.2 ZP i 5.2 ZR, 4.03.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=A8hnyIWwdYs.
- Reakcje kwasów z zasadami
Zapis cząsteczkowy: KOH + HCl → KCl + H2O
Zapis jonowy: K+ + OH- + H+ + Cl- → K+ + Cl- + H2O
Zapis jonowy skrócony: OH- + H+ → H2O
Źródło: Oficyna Pazdro, Reakcja zobojętniania: Doświadczenie 8.3, 26.03.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=2fl27LWrYo0.
Reakcje metali z kwasami
Zn + 2 HCl → ZnCl2 + H2
Źródło: Oficyna Pazdro, Reakcja cynku z kwasem solnym: Doświadczenie 6.10, 10.11.2017
[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=jRdFkO0J0cI.
Reakcje tlenków metali z kwasami
Na2O + 2HCl → 2NaCl + H2O
- Reakcje tlenków niemetali z zasadami
SO3 + 2KOH → K2SO4 + H2O
- Reakcje tlenków metali z tlenkami niemetali
CaO + CO2 → CaCO3
- Reakcje soli z kwasami
CaCO3 + 2 HCl → CaCl2 + H2O · CO2↑
Źródło: Oficyna Pazdro, Reakcja węglanu wapnia z kwasem solnym: Doświadczenie 8.9, 26.03.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=cIfkfiKDATk.
- Reakcje soli z zasadami
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2SO4
2 FeCl3 + 3 Ca(OH)2 → 2 Fe(OH)3↓ + 3 CaCl2
(NH4)2SO4 + 2 NaOH → Na2SO4 + 2 NH3↑ + 2 H2O
Źródło: Oficyna Pazdro, Rozkład soli amonowej pod wpływem zasady: Doświadczenie 8.11, 26.03.2020
[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=hqJSUgH413U.
- Reakcje soli z solami
AgNO3 + NaCl → AgCl↓ + NaNO3
Pb(NO3)2 + 2 KI → PbI2↓ + 2 KNO3
Źródło: Oficyna Pazdro, Strącanie osadów substancji trudno rozpuszczalnych: Doświadczenie 8.4, 26.03.2020
[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=REEtHAkUKoA.
Budowa i właściwości fizyczne
Sole to najszersza grupa spośród omawianych. Wspólną ich cechą jest jednak stan skupienia, przede wszystkim są to ciałą stałe. Natomiast pod wzgledem innych właściwości fizycznych, np. takich jak ropuszczalność czy barwa, są bardzo zróżnicowane. Warto podkreślić, iż sole dobrze rozpuszczalne w wodzie, w wodzie dysocjują z utworzeniem kationów metalu i anionów reszty kwasowej, i przewodzą prąd elektryczny.
KCl → K+ + Cl-
Poniżej zamieszczono tablice rozpuszczalności przykładowych soli w wodzie.
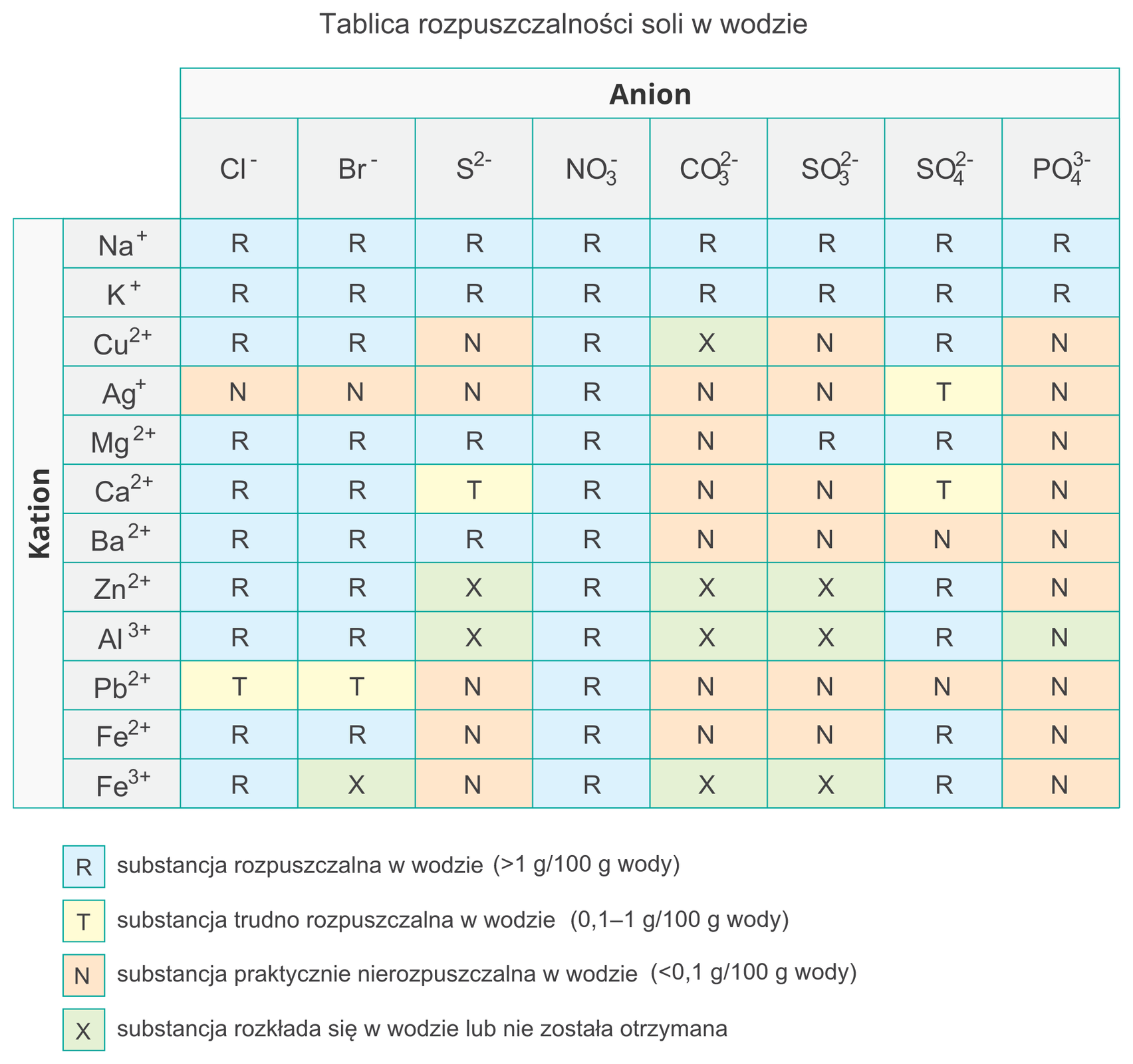
Grafika: Tablica rozpuszczalności soli w wodzie*. Źródło: epodreczniki.pl, licencja: CC BY-SA 3.0.
Właściwości chemiczne
- Rozkład termiczny lub fotochemiczny
NH4Cl → NH3↑ + HCl
NH4SO4 → NH3↑ + H2SO4
Źródło: Oficyna Pazdro, Rozkład termiczny chlorku amonu: Doświadczenie 8.10, 26.03.2020
[dostęp: 1.03.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=3BVYpNEX1Yc.NaHCO3 → NaCO3 + H2O + CO2↑
- Wymiana podwójna
- stracanie substancji słaborozpuszczalnej: AgNO3 + KCl → AgCl↓+ KNO3
- tworzenie słabego elektrolitu: Na2CO3 + 2 HCl → 2 NaCl + H2O · CO2
- Wymiana pojedyncza
Zn + CuSO4 → ZnSO4 + Cu
Źródło: Oficyna Pazdro, Reakcja cynku z siarczanem(VI) miedzi(II): Doświadczenie 3.1. ZP i 2.1. ZR, 1.10.2020[dostęp: 1.03.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=h9rX6GVpxts.
- Hydroliza
Hydroliza soli – reakcja chemiczna zachodząca zaraz po dysocjacji elektrolitycznej soli w trakcie rozpuszczania ich w wodzie. Reakcja ta powoduje, że roztwory wielu soli nie mają obojętnego pH lecz są bardziej lub mniej kwaśne lub zasadowe
Hydrolizie ulegają sole:
- mocnych kwasów i słabych zasad
- słabych kwasów i mocnych zasad
- słabych kwasów i słabych zasad
Hydrolizie nie ulegają sole mocnych kwasów i mocnych zasad
Źródło: Oficyna Pazdro, Badanie odczynu wodnych roztworów wybranych soli: Doświadczenie 2.7. ZP i 1.9. ZR, 1.10.2020[dostęp: 1.03.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=QUu9226qph0.
Krok
1. Ustalić jaka to sól
Czy jest to sól mocnego czy słabego kwasu i słabej lub mocnej zasady?

Krok 2. Zapisujemy równanie reakcji soli z wodą
NaHCO3 – sól słabego kwasu i mocnej zasady
NaHCO3 + H2O → NaOH + H2O · CO2 hydroliza anionowa
Na+ +HCO3- + H+ + OH- → Na+ + OH- + H2O · CO2 pH>7
NH4Cl – sól mocnego kwasu i słabej zasady
NH4Cl + H2O → NH3 · H2O + HCl hydroliza kationowa
NH4+ + Cl- + H+ + OH- → NH3 · H2O + H+
+ Cl- pH<7
NaCl – sól mocnego kwasu i mocnej zasady – nie hydrolizuje
NH4HCO3 – sól słabego kwasu i mocnej zasady
NH4HCO3 + H2O → NH3·H2O + H2O · CO2 hydroliza kationowo-anionowa
NH4+ + HCO3- + H+ + OH- → NH3 · H2O + H2O · CO2
O odczynie decyduje różnica mocy elektrolitów (można ją ustalić na podstawie wartości stałych dysocjacji.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
7. Chemia związków nieorganicznych, a minerały i skały
Minerały to krystaliczne ciała stałe będące pierwiastkami lub związkami chemicznymi utworzonymi w procesach geologicznych lub kosmologicznych.
Podstawą klasyfikacji minerałów jest ich skład chemiczny oraz struktura. Zgodnie z kryterium składu chemicznego minerały podzielono na podstawowe grupy:
- pierwiastki rodzime,
- siarczki i siarkosole i pokrewne kruszce,
- halogenki,
- tlenki i wodorotlenki,
- azotany,
- węglany,
- borany,
- siarczany,
- chromiany,
- molibdeniany,
- wolframiany,
- fosforany,
- wanadany,
- krzemiany i glinokrzemiany.
Wymienione powyżej to jedynie te, które odgrywają jako np. minerały skałotwórcze Ziemi, istotną rolę w przyrodzie i gospodarce surowcami mineralnymi (minerały użyteczne, nośniki rzadkich poszukiwanych pierwiastków).
7.1. Przykłady minerałów
Pierwiastki rodzime
Wśród nich wydziela się: metale rodzime, ich stopy i związki międzymetaliczne; metale kruche rodzime, ich stopy i związki międzymetaliczne; niemetale rodzime. Metale rodzime to przede wszystkim: miedź (Cu), srebro (Ag), złoto (Au), platyna (Pt), rteć (Hg), żelazo (Fe). Metale kruche to m.in. arsen (As), bizmut (Bi), antymon (Sb). Niemetale rodzime to głównie alotropowe odmiany węgla - grafit i diament oraz siarka.
Siarczki i siarkosole i pokrewne kruszce
Siarczki to związkami metali z siarką. Można tu wyróżnić zarówno siarczki proste jak i złożone.
Poniżej kilka wybranych przykładów minerałów z grupy siarczków, arsenków, tellurków i siarkosoli.

Halogenki
Halogenki to z punktu widzenia składu chemicznego sole kwasów beztlenowych takich jak HF, HCl, HBr, HI, a wieć fluorki, chlorki, bromki i jodki. W tej grupie minerałów najbardziej rozpoznawalne są:

Tlenki i wodorotlenki
Poniżej kilka wybranych przykładów minerałów z grupy tlenków i wodorotlenków.

W tej grupie z punktu widzenia składu chemicznego powinien się również znaleźć SiO2. Jednak ze względu na własności krystalochemiczne minerałów grupy SiO2 (np. kwarc, trydymit i inne) są one zaliczane do krzemianów.
 Dla ciekawych poniżej załączono animację Czy tlenki są drogocenne?
Dla ciekawych poniżej załączono animację Czy tlenki są drogocenne?
Animacja: Czy tlenki są drogocenne?*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Azotany
Przykłady azotanów naturalnie występujących w przyrodzie to:
Saletra chilijska zawierająca nitronatyt - NaNO3,
Saletra indyjska zawierająca nitronatyt - NaNO3 i nitrokalit - KNO3.
Węglany
W poniższej tabeli zestawiono przykłady minerałów z grupy węglanów.

Siarczany
Poniżej kilka wybranych przykładów minerałów z grupy siarczanów.

Fosforany
W poniższej tabeli zestawiono przykłady minerałów z grupy fosforanów:

Chromiany,
molibdeniany, wolframiny, wanadany
W poniższej tabeli zestawiono przykłady minerałów z grupy cheomianów, molibdenianów, wolframianów czy wanadanów.

7.2. Przykłady minerałów z grupy krzemianów i glinokrzemianów
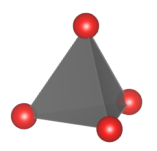
Krzemiany wyspowe - zawierają samodzielne aniony [SiO4]4-.

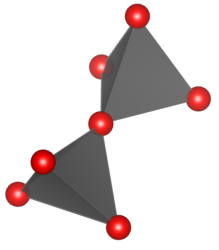
Krzemiany grupowe – krzemiany zawierające aniony [Si2O7]6- powstałe w wyniku kondensacji dwóch anionów [SiO4]4-.
Krzemiany i glinokrzemiany pierścieniowe – głównym motywem strukturalnym są jony [SiO4]4− tworzące struktury pierścieniowe. Ponieważ każdy z czworościanów styka się dwoma narożami z czworościanami sąsiednimi, tworząc układ cykliczny, pierścienie mogą się składać z od trzech do kilkunastu czworościanów, o następujących wzorach: [Si3O9]6−, [Si4O12]8−, [Si6O18]12−.

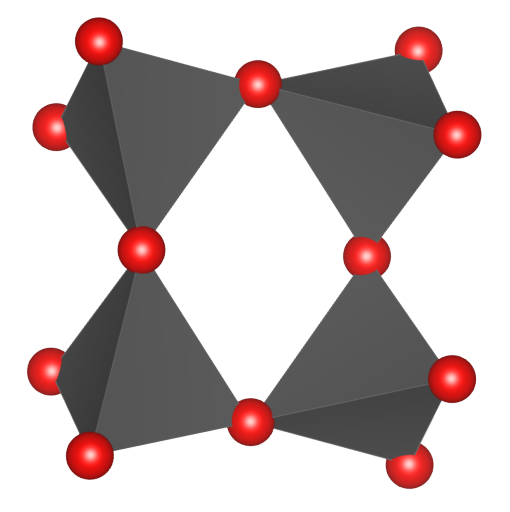
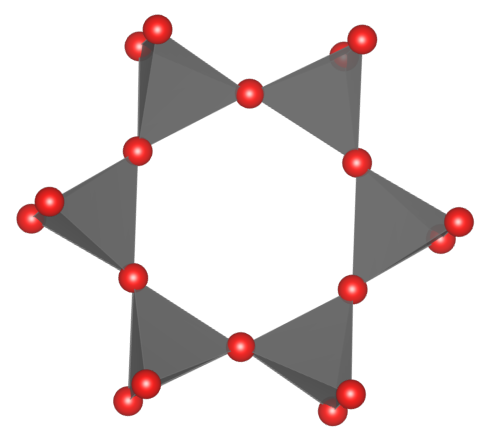
W tej grupie znajdują się minerały z grupy kordierytu, z grupy beryli i turmaliny.
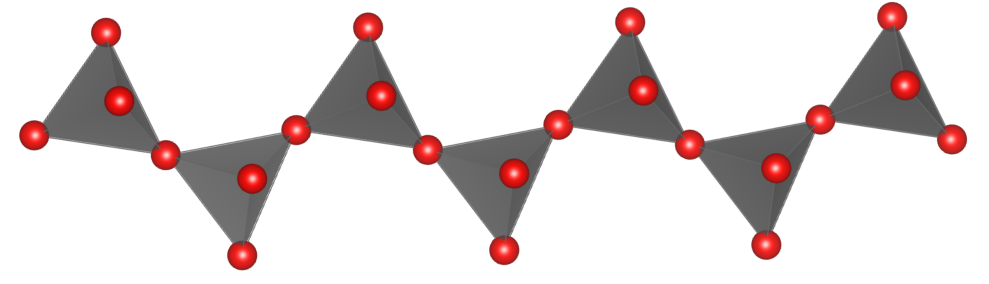
Krzemiany i glinokrzemiany łańcuchowe – to krzemiany zawierające aniony [SiO4]4- lub [AlO4]5- tworzące łańcuchy w taki sposób, że każdy czworościan łączy się z dwoma innymi. W tej grupie typowymi przedstawicielami są pirokseny.
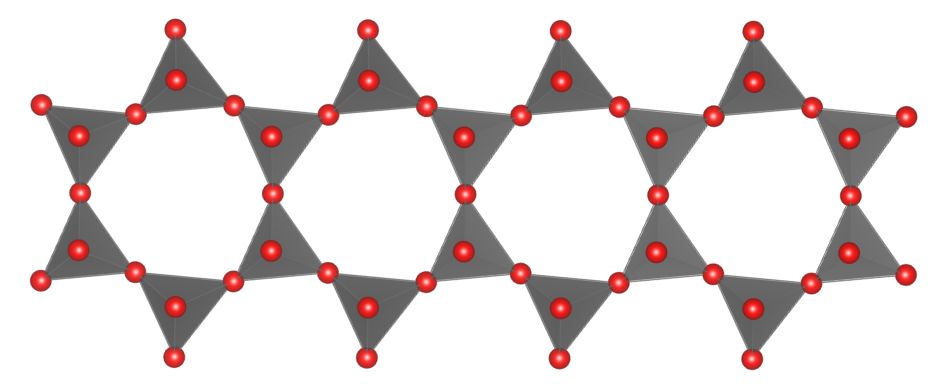
Krzemiany i glinokrzemiany wstęgowe – to krzemiany, których cechą wyróżniającą są tetraedry [SiO4]4- lub [AlO4]5- połączone w formę wstęgi powstałej w wyniku kondensacji dwóch łańcuchów. Reprezentantami tej grupy minerałów są amfibole.

Krzemiany i glinokrzemiany warstwowe – to minerały zawierające aniony [SiO4]4- lub [AlO4]5- połączone ze sobą w dwóch kierunkach przestrzeni tworząc warstwy.


Krzemiany przestrzenne – nazywane także krzemianami szkieletowymi to krzemiany o trójwymiarowych połączeniach czworościanów krzemowo-tlenowych
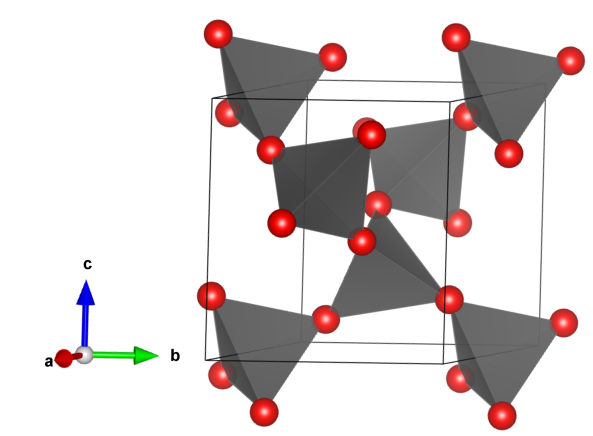

Grafiki krzemianów: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. plików cif dla odpowiednich minerałów zdeponowanych w American Mineralogist Crystal Structure Database]
8. Bibliografia
Adam Bielański, Podstawy chemii nieorganicznej. Warszawa : Wydawnictwo Naukowe PWN, 2013.
Robert Gill, Chemical Fundamentals of Geology and Environmental Geoscience. Sussex : Wiley-Blackwell, 2015.
Krzysztof M. Pazdro, Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.
Andrzej Manecki, Mineralogia szczegółowa : rozpoznanie, występowanie, znaczenie minerałów. Kraków : Mineralpress, 2019.
Dariusz Witowski, Jan S. Witowski, Chemia - zbiór zadań wraz z odpowiedziami - tom 1-4 (2002-2019) dla kandydatów na uniwersytety medyczne i kierunki przyrodnicze zdających maturę z chemii. Łańcut : Oficyna Wydawnicza "Nowa Matura".